
Давно неоспоримым является тот факт, что периоперационная анемия часто встречается в клинической практике и ухудшает исходы оперативного лечения.
C одной стороны, оперативное вмешательство ассоциировано с риском кровопотери, что может привести к развитию железодефицитной анемии в послеоперационном периоде.
С другой, — пациенты, которым запланировано плановое хирургическое вмешательство, могут иметь хронические воспалительные заболевания в анамнезе или опухоли, что провоцирует развитие анемии хронического воспаления1.
Кроме того, анемия может развиться на фоне лечения основного заболевания. Так, например, назначение химио- и лучевой терапии может приводить к железодефицитным состояниям у пациентов с онкологическими заболеваниями2-4.
В дополнение к этому анемия может быть следствием хронической кровопотери у плановых хирургических пациентов. Например, у большинства женщин с миомой матки обильные менструальные кровотечения, которые могут приводить сначала к дефициту железа, а потом и к железодефицитной анемии5.
Однако несмотря на то, что данное патологическое состояние лежит в плоскости интересов врачей многих специальностей: хирургов различных терапевтических направлений, которые проводят обширные оперативные вмешательства с высокими рисками интраоперационных кровопотерь, трансфузиологов, анестезиологов-реаниматологов — именно последним чаще всего приходится сталкиваться с разнообразием клинических ситуаций связанных с периоперационной анемий в своей повседневной практике. Периоперационная анемия сопровождает около двух третей пациентов в отделениях реанимации и интенсивной терапии, увеличивая тяжесть состояния и длительность пребывания, связанными с развитием органных дисфункций на фоне анемии и других осложнений58-61.
Поэтому неудивителен тот факт, что в международном медицинском сообществе именно анестезиологи-реаниматологи занимают лидирующую роль в вопросах диагностики и эффективной коррекции анемии у хирургического пациента, о чем свидетельствуют регулярно обновляющиеся руководства по периоперационной анемии американского и европейского обществ анестезиологов, а так же консенсусные руководства.

Среди пациентов, которым выполняют хирургическое вмешательство, часто встречается анемия6. До 40% плановых хирургических пациентов перед операцией имеют анемию. Дефицит железа у них развивается еще чаще.

Тем не менее, в зависимости от хирургической области частота предоперационной анемии может несколько варьировать8-10, 23.


Анемия на предоперационном этапе оказывает негативное влияние на исходы у пациента8,11.
Анемия на предоперационном этапе ассоциируется с:
Выше смертность
В 2015 году был опубликован систематический обзор и метаанализ 24 обсервационных исследований, где приняло участие 949 445 пациентов, которым выполнялись крупные хирургические операции. Авторы изучали связь предоперационной анемии с послеоперационными исходами. Они обнаружили, что во всех включенных исследованиях регистрировались смерти. В общей сложности 22 408 пациентов (2,4%) умерли в течение 30 дней после операции или до выписки из больницы. Пациенты с анемией умирали почти втрое чаще (ОШ 2,90, 2,30–3,68; P < 0,001), чем пациенты без анемии8.

Больше осложнений
Авторы также обнаружили, что у пациентов с анемией наблюдалось 3,75-кратное повышение риска острого повреждения почек (ОШ 3,75, 2,95–4,76; P < 0,001) и 1,93-кратное повышение риска развития инфекции (ОШ 1,93, 1,17–3,18; P = 0,01) по сравнению с пациентами без анемии8. Кроме того, у пациентов кардиохирургического профиля анемия ассоциировалась с 1,28-кратным повышением риска развития инсульта (ОШ 1,28, 1,06–1,55; P = 0,009)8.

Выше вероятность гемотрансфузий
Исследуя связь между предоперационной анемией и трансфузией эритроцитов, Fowler A.J. и соавторы обнаружили, что у пациентов с анемией наблюдалась более высокая вероятность проведения гемотрансфузии, чем у пациентов без анемии (ОШ 5,04, 4,12–6,17; P < 0,001)8.

Более длительные госпитализации
Очевидно, что перечисленные состояния негативно влияют на послеоперационный период, удлиняя время пребывания в больнице.
В своем ретроспективном одноцентровом когортном исследовании с участием 7 759 пациентов в возрасте старше 18 лет, перенесших некардиохирургическую операцию, Beattie W.S. и соавторы обнаружили, что пациенты с анемией находились в стационаре на 22% дольше, чем пациенты без анемии11.

С учетом перечисленных осложнений, период восстановления и возвращения к нормальной жизни после выписки у пациентов с нескорректированной предоперационной анемией существенно увеличен.




Традиционно врачи, учитывая риск кровопотери в ходе операции у пациентов со среднетяжелой анемией, прибегали к плановым гемотрансфузиям для нормализации уровня гемоглобина.
Тем не менее, на сегодня известно, что у пациентов со стабильной гемодинамикой это не самая эффективная тактика, которая сопряжена с характерными рисками для пациента и может потребовать дополнительных диагностических и лечебных вмешательств, включающих применение вазопрессоров, поддержку гемодинамики, интубацию или перевод в отделение интенсивной терапии13.
Риски
Несмотря на то, что современные подходы к переливанию эритроцитарной массы привели к снижению частоты осложнений, однако по-прежнему, они не исключены14:

* — в порядке от наиболее частых до наиболее редких.
Переливание эритроцитарной массы может ухудшать прогноз для пациента15.
- 6-кратно выше смертность в 30-дневный период в группе пациентов, кому проводилось переливание (p < 0,0001)15.
- Показатель смертности в группе пациентов, кому не проводилось переливание, оставался ниже в течение года и далее15.

- Частота инфекционных осложнений выше.
- Частота ишемических осложнений выше.

- Осложнения переливаний приводят к более длительному пребыванию в стационаре.
Эффективность
Очевидно, что в ряде случаев переливание эритроцитарной массы является единственной возможной тактикой, направленной на спасение жизни пациента. Однако, если гемодинамика пациента стабильна, все больше специалистов трансфузиологов отдают предпочтение рестриктивному (ограничительному) подходу к гемотрансфузиям, при котором вопрос о проведении переливания ставится не раньше, чем при уровне гемоглобина 70 г/л и ниже.


Доктор Андреас Майер-Хеллман и его коллеги из клиники Helios в Эрфурте, Германия, использовали цитосканирование для съемки сублингвальной микроциркуляции до и после переливания у пациента с тяжелым желудочно-кишечным кровотечением. Гемоглобин пациента упал до 28 г/л16.



В России традиционно за подготовку пациента к плановой операции отвечает амбулаторное звено. Как правило, терапевты проводят ряд обязательных обследований, включающих, в том числе исследование уровня гемоглобина.
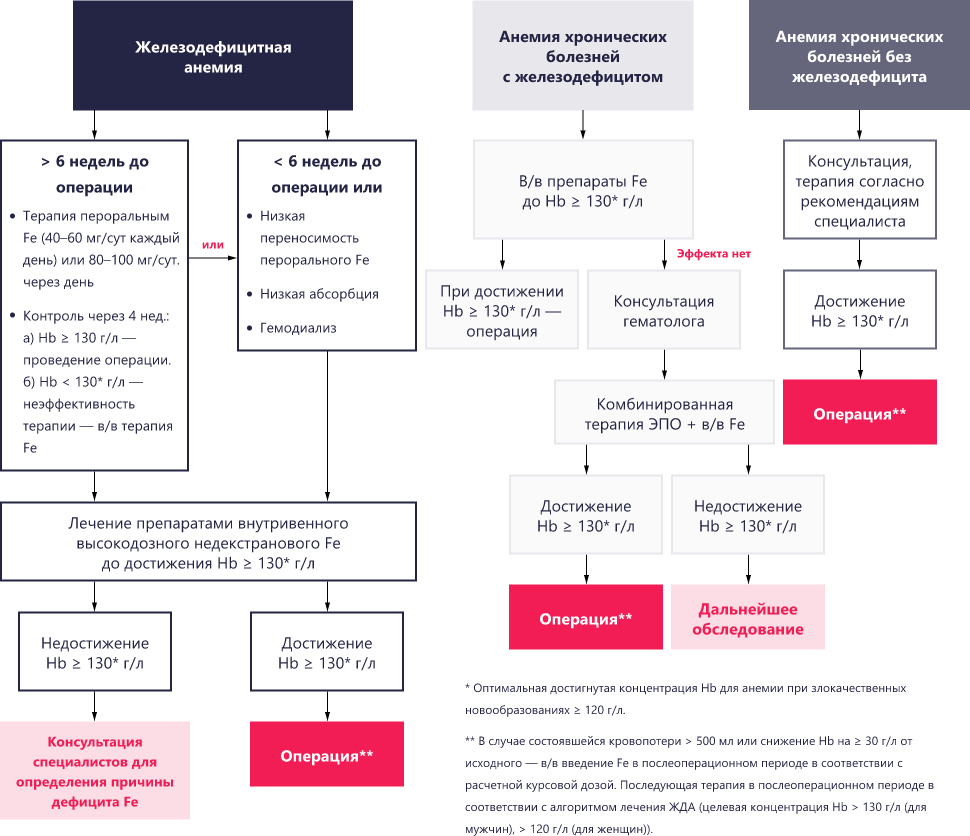
В 2021 году для врачей амбулаторного звена коллективом авторов, входящими в состав Российского общества профилактики неинфекционных заболеваний, были опубликованы Алгоритмы ведения пациентов с железодефицитной анемией на этапе оказания первичной медико-санитарной помощи17.
Алгоритмы уточняют типы хирургических вмешательств, при которых целесообразно проводить оценку статуса железа, не ограничиваясь скринингом гемоглобина, суммируют основные шаги дифференциальной диагностики разных видов анемии у пациентов с ЖДА перед плановой операцией и предлагают разную лечебную тактику.
Перечень показаний, при которых целесообразно проводить предоперационную оценку концентрации железа/уровня эритроцитов в организме у пациентов хирургического профиля18

Кардиоторакальная хирургия
- Протезирование клапанов сердца
- Аорто-коронарное шунтирование
- Протезирование при аневризме дуги аорты
- Пневмонэктомия/лобэктомия
- Повторное оперативное вмешательство с торакотомией

Акушерство/гинекология
- Беременность с высоким риском кровотечений
- Миомэктомия (без эмболизации)
- Врастание плаценты
- Абдоминальная гистерэктомия при миоме матке

Нейрохирургия
- Аневризма сосуда головного мозга

Урология
- Радикальная позадилонная простатэктомия (кроме роботизированной простатэктомии)
- Цистэктомия
- Нефрэктомия

Пластическая хирургия
- Уменьшение/реконструкция молочной железы
- Пересадка крупных участков кожи

Ортопедия
- Спондилосинтез (более двух уровней)
- Протезирование коленного сустава
- Протезирование тазобедренного сустава
- Перелом таза
- Переломы длинных костей нижних конечностей

Общая хирургия
- Резекция печени (без эмболизации)
- Операция Випла
- Спленэктомия
- Любая открытая абдоминальная операция
- Колонэктомия/резекция кишки

Сосудистая хирургия
- Аортобифеморальное шунтирование
- Вмешательство по поводу аневризмы торакоабдоминального отдела аорты
- Аксиллярно-феморальное шунтирование
- Реваскуляризация нижних конечностей

Другие
- Любые вмешательства у пациента, который отказывается от гемотрансфузий, даже если его жизнь в опасности

Несмотря на направленность Алгоритмов на амбулаторное звено, подходы, изложенные в ней, вполне применимы и для врачей, принимающих решение о возможности проведения операции на госпитальном этапе.


При подготовке пациента к операции у врача в арсенале есть пероральные и парентеральные препараты железа19,20.

Согласно Алгоритмам ведения пациентов с ЖДА перед операцией, выбор в пользу таблетированной или пероральной терапии делается в зависимости от времени, которое есть у врача в запасе на лечение анемии, эффективности и переносимости назначенной в качестве первой линии терапии препаратов, а также наличия хронических заболеваний21,22.

Инструкция по медицинскому применению лекарственного препарата Феринжект®/Ferinject®
Инструкция по медицинскому применению лекарственного препарата Феринжект®/Ferinject®



Это связано с тем, что пероральные препараты железа характеризуются низкой биодоступностью (10–15%) и низкой абсорбцией25, которая может быть еще более низкой при стимуляции гепсидином при воспалительных состояниях25. Кроме того, желудочно-кишечная непереносимость пероральных добавок железа может послужить причиной низкой приверженности пациента лечению22.

С другой стороны, внутривенные препараты железа более эффективно повышают уровень гемоглобина, в сравнении с пероральными препаратами железа23, обеспечивая тем самым более быстрое восполнение запасов железа23. Кроме того, внутривенные препараты железа не вызывают побочных эффектов со стороны желудочно-кишечного тракта и характеризуются хорошей приверженностью пациентов проводимой терапии23.


Удобно ввести высокие дозы за короткое время, которое ограничено перед операцией, можно при помощи препарата карбоксимальтозат железа.

К настоящему моменту проведено более десятка исследований, оценивающих роль препарата карбоксимальтозат железа при ведении пациентов с предоперационной анемией.

Анемия наблюдается у 90% пациентов в ближайшем послеоперационном периоде после большой операции28. Основными причинами являются: наличие предоперационной анемии, периоперационная кровопотеря, недостаточное питание в послеоперационном периоде, частый забор крови для лабораторных исследований. Кроме того, повышенная концентрация гепцидина из-за воспалительного ответа на хирургическое вмешательство может привести к ингибированию всасывания железа из тонкой кишки и уменьшению поступления железа из запасов (секвестрация железа)29. Эти эффекты могут длиться в течение нескольких недель после большой операции и усугубить послеоперационную ЖДА30.

Послеоперационная анемия потенциально может влиять на выздоровление, реабилитацию, повторную госпитализацию и повторную операцию, а также состояние пациента.
Было проведено небольшое количество исследований, посвященных изучению последствий послеоперационной анемии на этапе восстановления после операции, в ходе которых была доказана связь между послеоперационной анемией и неблагоприятными исходами, такими как длительное выздоровление, повышенная летальность и вероятность повторной госпитализации31-33, а так же потенциальная связь с развитием в ранние сроки после операции инфаркта миокарда34.



Европейские рекомендации по периоперационному лечению анемии еще с 2013 г.35,36 отмечают, что «предоперационная анемия у взрослых и детей является четким предиктором интраоперационной гемотрансфузии в различных областях хирургии и ассоциируется с развитием осложнений» с уровеннем доказательности В. Решение было принято в пользу применения ограничительной трансфузионной стратегии с уровнем уровень доказательности 1A.
Целесообразность данного подхода подтверждена множеством клинических исследований.
Так в исследовании Goodnough L.T. с совт. было показано, что уменьшение гемотрансфузий в послеоперционном периоде улучшает отдаленные результаты и повышает выживаемость37.
Результаты крупного американского ретроспективного исследования показали, что трансфузия даже одной единицы эритроцитной массы в день операции или на следующие сутки ассоциируется с увеличением риска развития периоперационного инсульта/инфаркта миокарда (скорректированное отношение рисков 2,33; 95% ДИ 1,90–2,86), которое было более выраженным в случае трансфузии 4 единиц и более38.
Массивная гемотрансфузия также стимулирует системный воспалительный ответ и значительно повышает частоту гнойно-септических осложнений послеоперационного периода39.
К настоящему времени преимущества ограничительной (рестриктивной) трансфузионной тактики в периоперационном периоде доказаны практически во всех областях хирургии.
Таким образом, в современном медицинском сообществе приветствуются альтернативные гемотрансфузиям подходы для улучшения кислородно-транспортной функции крови. Гемотрансфузии рассматриваются как ургентный метод лечения анемии со строгими обоснованными показаниями. В этой связи перспективным методом лечения служит терапия железосодержащими препаратами40.

Определение концентрации Hb является рутинной процедурой в послеоперационном периоде. Длительность тестирования для выявления послеоперационной анемии зависит от риска кровотечения во время хирургического вмешательства и характеристик пациента. В большинстве случаев неосложненного течения послеоперационного периода самая низкая концентрация Hb наблюдается в первые 3–4 дня после операции. Однако пациенты с серьезными осложнениями после большой операции, длительно находящиеся в стационаре и с низкой концентацией Hb, нуждаются в длительном мониторинге этого показателя23.
ДЛЯ ВЫЯВЛЕНИЯ АНЕМИИ ВО ВРЕМЯ ВОССТАНОВЛЕНИЯ ПОСЛЕ НЕОСЛОЖНЕННОЙ БОЛЬШОЙ ОПЕРАЦИИ КОНЦЕНТРАЦИЮ ГЕМОГЛОБИНА (HB) СЛЕДУЕТ КОНТРОЛИРОВАТЬ ЕЖЕДНЕВНО ЛИБО В ОБЩЕБОЛЬНИЧНОЙ ЛАБОРАТОРИИ, ЛИБО У ПОСТЕЛИ БОЛЬНОГО, ПО КРАЙНЕЙ МЕРЕ, ДО ТРЕТЬЕГО ДНЯ ПОСЛЕ ОПЕРАЦИИ (У МУЖЧИН ЗА АНЕМИЮ ПРИНИМАЮТ HB МЕНЕЕ 130 Г/Л, У ЖЕНЩИН — МЕНЕЕ 120 Г/Л).
Послеоперационная анемия имеет многофакторную природу, однако дефицит железа является наиболее частой ее причиной.
Основным маркером послеоперационного дефицита железа являются показатель сыворточного ферритина (СФ). Однако диагностика послеоперационного дефицита железа представляется более сложной задачей, поскольку концентрация СФ может быть повышена в ответ на острое воспаление после операции42.
Поскольку концентрация СФ не повышается за счет воспаления сразу же после операции, концентрация СФ более 100 мкг/л в течение 24 часов после операции указывает на недостаточные запасы железа в организме для поддержания эритропоэза, что может привести к значительному снижению концентрации Hb после операции43.
Другими маркерами послеоперационного дефицита железа являются НТЖ менее 20% при концентрации СФ 100–300 мкг/л или среднее содержание Hb в ретикулоците менее 28 пг. Такие значения указанных показателей могут свидетельствовать о необходимости лечения пациентов с анемией41.
В ПОСЛЕОПЕРАЦИОННОМ ПЕРИОДЕ ЗА ДЕФИЦИТ ЖЕЛЕЗА ПРИНИМАЮТ КОНЦЕНТРАЦИЮ СЫВОРОТОЧНОГО ФЕРРИТИНА (СФ) МЕНЕЕ 100 МКГ/Л, ИЛИ КОНЦЕНТРАЦИЮ СФ МЕНЕЕ 100–300 МКГ/Л И КОЭФФИЦИЕНТ НАСЫЩЕНИЯ ТРАНСФЕРРИНА ЖЕЛЕЗОМ (НТЖ) МЕНЕЕ 20%, ИЛИ СРЕДНЕЕ СОДЕРЖАНИЕ HB В РЕТИКУЛОЦИТЕ МЕНЕЕ 28 ПГ. ТЯЖЕЛАЯ КРОВОПОТЕРЯ ВО ВРЕМЯ ОПЕРАЦИИ МОЖЕТ ТАКЖЕ УКАЗЫВАТЬ НА НЕОБХОДИМОСТЬ ВОСПОЛНЕНИЯ ЗАПАСОВ ЖЕЛЕЗА У ПАЦИЕНТОВ С АНЕМИЕЙ.

Лекарственная коррекция концентрации Hb и эритропоэза должна помочь устранить дефицит железа и обеспечить быстрое выздоровление от послеоперационной анемии, что может привести к улучшению результатов послеоперационного периода и улучшению качества жизни. Она также может привести к уменьшению гемотрансфузий и связанных с ними рисков и осложнений, что будет способствовать дальнейшему улучшению результатов операции и безопасности пациентов41.
В послеоперационном периоде пероральные препараты железа имеют ряд ограничений, включая частые нежелательные явления со стороны желудочно-кишечного тракта и, как следствие, плохую приверженность к лечению41.
РКИ у пациентов, перенесших ортопедические и кардиохирургические операции, показали, что пероральные препараты железа по своей эффективности сопоставимы с плацебо в лечении послеоперационной анемии и снижении потребности в переливании эритроцитной массы44-50.
Напротив, внутривенные препараты железа были успешно использованы для лечения ЖДА после операции по поводу артропластики нижних конечностей, гастроэктомии и послеродового кровотечения30. Назначение препаратов железа следует рассматривать у пациентов с дефицитом железа или значительным снижением концентрации Hb после операции в ранние сроки восстановления после операции, до развития потенциальных послеоперационных осложнений51-53.
Packed red blood cells should only be transfused in patients with severe anemia (Hb less than 70–80 g/L) and clinical symptoms 54-56 .
After discharge from the hospital, treatment tactics for patients with blood loss exceeding 500 ml, or a decrease in hemoglobin after surgery, are determined by the algorithms for managing a patient with iron deficiency anemia at the stage of PSMP 17 .
The algorithms also define:
Intravenous administration of iron in accordance with the course dose

It is convenient to administer high doses with iron carboxymaltose (Ferinject®).

К настоящему моменту проведено более десятка исследований, оценивающих роль препарата карбоксимальтозат железа при ведении пациентов с послеоперационной анемией.
- Goodnough L. Transfusion 2012; 52: 1585–92.
- Fraenkel P.G. (2017). Med Clin North Am 101(2): 285–296.
- Clara Camaschella, Hematology, 2015.
- Madu et al. Med Princ Pract. 2017 Jan; 26(1): 1–9.
- Болотова Е.В., Дудникова А.В., Крутова В.А. Частота и особенности железодефицитных состояний у женщин репродуктивного возраста. Клиническая медицина. 2020; 98(4): 287–293.
- Richards T. et al. PLoS One. 2015;10(7): e0130861.
- Kassebaum N.J. et al. Hematol Oncol Clin N Am 2016; 30: 247–308.
- Fowler A.J. et al. Br J Surg. 2015; 102(11): 1314–1324.
- Dunkelgrun M. et al. Am J Cardiol. 2008; 101(8): 1196–1200.
- Karkouti K. et al. Circulation. 2008; 117(4): 478–484.
- Beattie W.S. et al. Anesthesiology. 2009; 110: 574–581.
- Christian von Heymann et al. J Thorac Cardiovasc Surg 2016; 152: 1412–1420.
- Savinkina A.A. et al. Transfusion 2020; 60: 10–6.
- Leichtle S.W. et al. J Blood Dis Transf 2011; S1: 002.
- Murphy G.J. et al. Circulation 2007; 116: 2544–2552.
- https://www.youtube.com/watch?v=gV4Nmjg29p0
- Алгоритмы ведения пациентов с железодефицитной анемией на этапе оказания ПМСП/под редакцией О.М. Драпкиной. — М.: Видокс, 2021.
- Шевченко Ю.Л., Жибурт Е.Б., Шестаков Е.А. Внедрение кровесберегающей идеологии в практику Пироговского центра//Вестник Национального медико-хирургического центра им. Н.И. Пирогова. — 2008. — Т. 3, № 1. — С. 14–21.
- Percy L. et al. Best Pract Res. Clin Obstet Gynaecol. 2017; 40: 55–67.
- Geisser P. and Burckhardt S. Pharmaceutics. 2011; 3(1): 12–33.
- Camaschella C. N Engl J Med. 2015; 372(19): 1832–1843.
- Baird-Gunning J. et al. AustPrescr. 2016; 39(6): 193–199.
- Muñoz M. et al. International consensus statement on the peri-operative management of anaemia and iron deficiency. Anaesthesia 2017, 72, 233–247.
- Aapro M. и др. Клинические рекомендации по лечению анемии у больных злокачественными новообразованиями. 2014 г.
- Clevenger B. and Richards T. Anaesthesia. 2015; 70(Suppl 1): 20–28.
- Инструкция по медицинскому применению лекарственного препарата Фениржект®/Ferinject®.
- Beshara S. et al. Brit J Haematol. 2003; 120: 853–859.
- Shander A., Knight K., Thurer R., Adamson J., Spence R. Prevalence and outcomes of anaemia in surgery: a systematic review of the literature. American Journal of Medicine. 2004; 116 (Suppl. 7A): 58–69.
- Muñoz M., García-Erce J.A., Remacha A.F. Disorders of iron metabolism. Part II: iron deficiency and iron overload. Journal of Clinical Pathology 2011; 64: 287-96.
- Серов Владимир Николаевич и др. "Диагностика и лечение периоперационной анемии и дефицита железа у хирургических пациентов." (2021): 60–60.
- Koch C.G., Li L., Sun Z. et al. Magnitude of anemia at discharge increases 30-day hospital readmissions. Journal of Patient Safety 2017; 13: 202–6.
- Choi Y.J., Kim S.O., Sim J.H., Hahm K.D. Postoperative anemia is associated with acute kidney injury in patients undergoing total hip replacement arthroplasty: a retrospective study. Anesthesia and Analgesia 2016; 122: 1923–8.
- Pitter F.T., Jorgensen C.C., Lindberg-Larsen M., Kehlet H. Postoperative morbidity and discharge destinations after fasttrack hip and knee arthroplasty in patients older than 85 years. Anesthesia and Analgesia 2016; 122: 1807–15.
- Jorgensen C.C., Kehlet H. Early thromboembolic events ≤1 week after fast-track total hip and knee arthroplasty. Thrombosis Research 2016; 138: 37–42.
- Kozek-Langenecker S.A., Afshari A., Albaladejo P. et al. Management of severe perioperative bleeding: guidelines from the European Society of Anaesthesiology. Eur. J. Anaesthesiology, 2013, vol. 30, pp. 270–382.
- Kozek-Langenecker S.A., Aamer B.A., Afshari A. et al. Management of severe perioperative bleeding: guidelines from European Society of Anaesthesiology. First update 2016. Eur. J. Anaesthesiol, 2017, vol. 34, pp. 332–395.
- Goodnough L.T., Maggio P., Hadhazy E. et al. Restrictive blood transfusion practices are associated with improved patient outcomes. Transfusion 2014; 54: 2753–9.
- Whitlock E.L., Kim H., Auerbach A.D. Harms associated with single unit perioperative transfusion: retrospective population based analysis. BMJ 2015; 350: h3037.
- Валетова В.В. и др. "Интраоперационная ауто- и аллогемотрансфузия при массивной кровопотере в экстренной абдоминальной хирургии." Хирургия. Журнал им. Н.И. Пирогова 4 (2012): 4-8.
- Халикова Е.Ю., Силаев Б.В. "Коррекция анемии у пациентов в пред и послеоперационном периоде и у больных в критическом состоянии." Вестник анестезиологии и реаниматологии 17.2 (2020): 70-75.
- Muñoz M. at al. An international consensus statement on the management of postoperative anaemia after major surgical procedures. Anaesthesia 2019, 73, 1418–1431.
- Muñoz M., Garcıa-Erce J.A., Remacha A.F. Disorders of iron metabolism. Part 1: molecular basis of iron homoeostasis. Journal of Clinical Pathology 2011; 64: 281–6.
- Beris P., Muñoz M., Garcıa-Erce J.A., Thomas D., Maniatis A., van der Linden P. Perioperative anaemia management: consensus statement on the role of intravenous iron. British Journal of Anaesthesia 2008; 100: 599–604.
- Crosby L., Palarski V.A., Cottington E., Cmolik B. Iron supplementation for acute blood loss anemia after coronary artery bypass surgery: a randomized, placebo-controlled study. Heart and Lung 1994; 23: 493–9.
- Sutton P.M., Cresswell T., Livesey J.P., Speed K., Bagga T. Treatment of anaemia after joint replacement. A doubleblind, randomised, controlled trial of ferrous sulphate versus placebo. Journal of Bone and Joint Surgery Britain 2004; 86: 31–3.
- Weatherall M., Maling T.J. Oral iron therapy for anaemia after orthopaedic surgery: randomized clinical trial. ANZ Journal of Surgery 2004; 74: 1049–51.
- Mundy G.M., Birtwistle S.J., Power R.A. The effect of iron supplementation on the level of haemoglobin after lower limb arthroplasty. Journal of Bone and Joint Surgery Britain 2005; 87: 213–7.
- Zauber N.P., Zauber A.G., Gordon F.J. et al. Iron supplementation after femoral head replacement for patients with normal iron stores. Journal of the American Medical Association 1992; 267: 525–7.
- Prasad N., Rajamani V., Hullin D., Murray J.M. Post-operative anaemia in femoral neck fracture patients: does it need treatment? A single blinded prospective randomised controlled trial. Injury 2009; 40: 1073–6.
- Parker M.J. Iron supplementation for anemia after hip fracture surgery: a randomized trial of 300 patients. Journal of Bone and Joint Surgery America 2010; 92: 265–9.
- Bisbe E., Molto L., Arroyo R., Muniesa J.M., Tejero M. Randomized trial comparing ferric carboxymaltose vs oral ferrous glycine sulphate for postoperative anaemia after total knee arthroplasty. British Journal of Anaesthesia 2014; 113: 402–9.
- Muñoz M., Gomez-Ramırez S., Martın-Montanez E., Naveira E., Seara J., Pavıa J. Cost of post-operative intravenous iron therapy in total lower limb arthroplasty: a retrospective, matched cohort study. Blood Transfusion 2014; 12: 40–9.
- Kim Y.W., Bae J.M., Park Y.K. et al. and study group. Effect of intravenous ferric carboxymaltose on hemoglobin response among patients with acute isovolemic anemiafollowing gastrectomy: the FAIRY randomized clinical trial. Journal of the American Medical Association 2017; 317: 2097–2104.
- Liumbruno G.M., Bennardello F., Lattanzio A., Piccoli P., Rossetti G., Italian Society of Transfusion Medicine and Immunohaematology Working Party. Recommendations for the transfusion management of patients in the perioperative period. III. The post-operative period. Blood Transfusion 2011; 9: 320–335.
- Klein A.A., Arnold P., Bingham R.M. et al. AAGBI guidelines: the use of blood components and their alternatives 2016. Anaesthesia 2016; 71: 829–842.
- Carson J.L., Guyatt G., Heddle N.M. et al. Red blood cell transfusion: 2016 clinical practice guideline from the AABB. Annals of Internal Medicine 2016; 316: 2025–2035.
- Muñoz M. and Auerbach M. Lancet Haematol. 2016; 3:e401-402.
- Warner M.A., Shore-Lesserson L., Shander A. et al. Perioperative Anemia: Prevention, Diagnosis, and Management Throughout the Spectrum of Perioperative Care. Anesth Analg. 2020; 130(5): 1364–1380.
- Meybohm P., Neef V., Westphal S. et al. Preoperative iron deficiency with/without anemia-an underestimated risk factor? Chirurg. 2020; 91(2): 109–114.
- Lasocki S., Pène F., Ait-Oufella H. et al. Management and prevention of anemia (acute bleeding excluded) in adult critical care patients. Anaesth Crit Care Pain Med. 2020; S2352–5568(20)30070-9. DOI: 10.1016/j.accpm.2020.04.004.
- American Society of Anesthesiologists Task Force on Perioperative Blood Management. Practice guidelines for perioperative blood management: an updated report by the American Society of Anesthesiologists Task Force on Perioperative Blood Management. Anesthesiology. 2015; 122(2): 241–275.
 Более высокой вероятностью смертности8
Более высокой вероятностью смертности8 Более высокой вероятностью повреждения почек, инфекции и инсульта8
Более высокой вероятностью повреждения почек, инфекции и инсульта8  Более высоким риском трансфузии8
Более высоким риском трансфузии8 Более длительным пребыванием в больнице11
Более длительным пребыванием в больнице11 