



В настоящее время не разработано единых общепризнанных пороговых значений как для диагностики анемии, так и для определения ее тяжести. Отсутствие стандартизированных систем объективной оценки тяжести анемии и ее различных проявлений затрудняет количественную оценку данного состояния.
Для классификации степени тяжести анемии предложена шкала оценки анемии Национального онкологического института рака2,3:
- степень 0 = в пределах нормы = гемоглобин 12–16 г/дл для женщин и 14–18 г/дл для мужчин;
- дестепень 1 = легкая = 10–12 г/дл для женщин и 10–14 г/дл для мужчин;
- степень 2 = умеренная = 8–10 г/дл;
- степень 3 = тяжелая = 6,5–8 г/дл;
- степень 4 = жизнеугрожающая = <6,5 г/дл;
- степень 5 = смерть.


В России используется и другая классификация1:
- легкая степень анемии — снижение концентрации Hb в диапазоне от 100 до 119 г/л;
- средняя степень анемии — концентрация Hb от 80 до 99 г/л;
- тяжелая степень анемии — концентрация Hb ниже 80 г/л.


У онкологических больных отмечается высокая частота встречаемости дефицита железа, как связанного, так и не связанного с анемией и противоопухолевой терапией9.
Согласно данным исследования (CARENFER 2021 год) дефицит железа был обнаружен у 57,9% пациентов, из них функциональный дефицит железа составил 64%. ЖДА была зарегистрирована у 21,8% от всех пациентов. Дефицит железа у первичных пациентов, которые не получали лечение, встречался в 57,4% и у пациентов без анемии — в 54,1% случаев9.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ ПОДЧЕРКИВАЮТ НЕОБХОДИМОСТЬ ЛУЧШЕГО ВЫЯВЛЕНИЯ И ЛЕЧЕНИЯ ДЕФИЦИТА ЖЕЛЕЗА У ОНКОЛОГИЧЕСКИХ ПАЦИЕНТОВ, ТЕМ САМЫМ ПОВЫШАЯ КАЧЕСТВО ЖИЗНИ И РЕЗУЛЬТАТЫ СИСТЕМНОГО ПРОТИВООПУХОЛЕВОГО ЛЕЧЕНИЯ9.
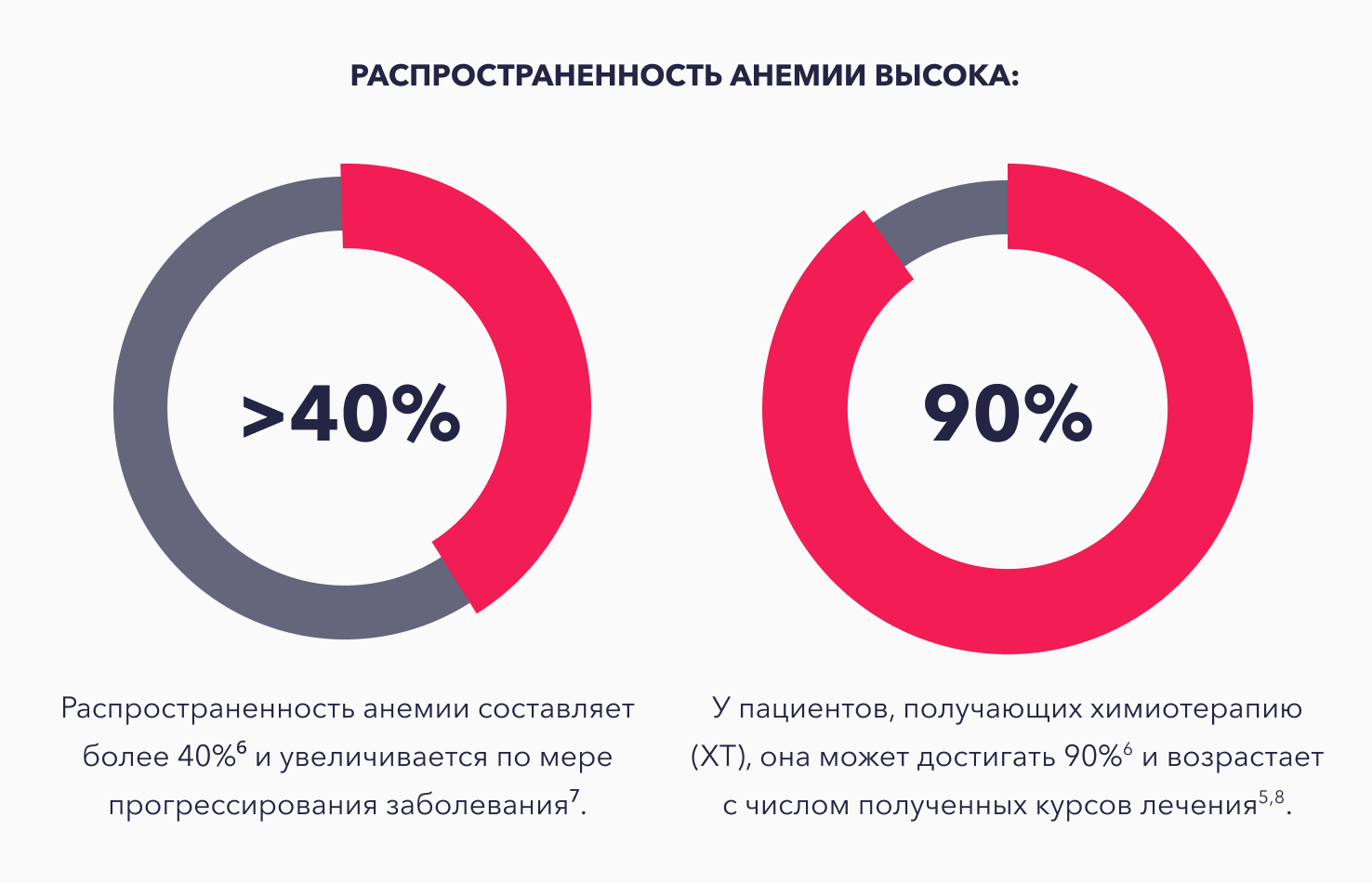
Анемия является одной из самых распространенных проблем во время лечения пациентов со злокачественными новообразованиями (ЗНО) и часто присутствует уже при постановке диагноза5.
Развитие анемии у онкологических больных обусловлено разными причинами.

Это может быть связано с наличием таких сопутствующих патологических процессов, как кровотечение, гемолиз, наследственные заболевания, почечная недостаточность, дефицит питательных веществ, анемия хронического заболевания или сочетание этих состояний.
Опухолевые клетки могут приводить к анемии или усугублять ее, проникая в костный мозг и подавляя эритропоэз. Опухолевые цитокины, такие как TNF-α, IL-β, IFN-γ, могут вызывать нарушение доступности железа и негативно влиять на выработку ЭПО (эритропоэтина) и созревание клеток-предшественников.
Хроническая кровопотеря в местах распада опухолей и повреждение органов могут также способствовать развитию анемии у онкологических больных11-14.
Гепсидин — основной регулятор гомеостаза железа
Ведущая роль в нарушении утилизации и/или обмена железа, которое проявляется снижением уровня сывороточного железа и общей железосвязывающей способности сыворотки, низким насыщением трансферрина, у онкологических больных отводится гепсидину.
Гепсидин — основной регулятор гомеостаза железа в организме. Это пептидный гормон, который продуцируется клетками печени и моноцитами. В печени экспрессия гена гепсидина регулируется двумя способами: первый зависит от доступности железа и сигнала с поверхности гепатоцитов; второй связан с любыми хроническими заболеваниями, включая онкологические. Воспаление способствует выработке провоспалительных цитокинов (особенно IL-6), что приводит к активации синтеза гепсидина в печени.



Железо не может мобилизоваться из депо ретикулоэндотелиальной системы (системы макрофагов) в достаточном количестве, в результате чего развивается функциональный дефицит железа (ФДЖ).
Функциональный дефицит железа приводит к снижению производства функциональных эритроцитов и гипопролиферативной или гипохромной анемии.
Гипохромная (микроцитарная) анемия характеризуется снижением концентрации гемоглобина и появлением маленьких эритроцитов в результате ФЖД.
Добавление экзогенного ЭПО приводит к увеличению активности костного мозга, увеличивая потребность в железе. Если железа недостаточно, возникает гипохромная анемия.
ДОБАВЛЕНИЕ ВНУТРИВЕННОГО ЖЕЛЕЗА К ЭРИТРОПОЭТИНАМ УЛУЧШАЕТ РЕАКЦИЮ НА НИХ, УДОВЛЕТВОРЯЯ ПОТРЕБНОСТЬ В ЖЕЛЕЗЕ20-28.
Связанная с онкологическим заболеванием анемия и анемия, вызванная противоопухолевой терапией, оказывают непосредственное влияние на выработку эритроцитов, подавляя продукцию эритропоэтина и снижая ответ клеток —предшественников эритроида на ЭПО, приводя к гипопролиферативной анемии.
Гипопролиферативная анемия — это проявление недостаточности эритропоэза. Эритроидный росток не развивается должным образом в ответ на анемию.
Анемия развивается у 90% пациентов при проведении противоопухолевой терапии. Многие противоопухолевые препараты ведут к угнетению гемопоэза.
Из классических цитостатиков особое внимание обращают на себя препараты платины29. Их нефротоксическое действие ведет к снижению синтеза эритропоэтина30. Факторы, которые ассоциированы с развитием анемии, вызванной препаратами платины, включают следующие: раннее снижение уровня гемоглобина после начала лечения, кумулятивная доза препарата платины, пожилой возраст, отсутствие ответа на химиотерапию и высокая концентрация остаточной платины в системном кровотоке после введения препарата31,32. Механизмы развития АВХ (анемии, вызванной химиотерапией) на фоне лечения препаратами платины включают прямое подавление эритроидных клеток-предшественников в костном мозге, а также нефротоксическое действие на эритропоэтин-продуцирующие клетки почек33,34. Состояния дефицита эритропоэтина, возникшие в результате цисплатин-индуцированного повреждения почечных канальцев, можно предотвратить или излечить путем заместительной рекомбинантной гормональной терапии24. Также особо сильный миелосупрессивный эффект могут оказывать режимы химиотерапии, основанные на неплатиновых препаратах, включая антимикротубулярные препараты, камптотецины и биологические препараты35,36.

По данным Dicato et al., при использовании препаратов из группы таксанов анемия развивается с частотой до 10% при назначении доцетаксела и 7% — паклитаксела. Винкаалкалоиды и фторпиримидины становятся причиной развития анемии у 14% и 11% пациентов соответственно 30.
Частота и тяжесть анемии зависят от режима химиотерапии и возрастают к 5-му циклу лечения. Чаще анемия развивается у пациентов с распространенными стадиями опухолевого процесса8.
Таргетная терапия, назначенная после химиотерапии, увеличивала риск развития анемии всех степеней тяжести на 7% (исследование Barni et al. 2012 год). Относительный риск развития анемии всех степеней тяжести у пациентов при таргетной терапии составил 44%, причем в 38,9% случаев у данной группы больных развивалась анемия 1–2 степени37.
Кровопотеря у онкологических пациентов может быть как острой, так и хронической (экзогенные кровотечения, внутриопухолевые кровоизлияния)38. Первый вариант встречается при проведении хирургического лечения опухолевого процесса, а также при развитии внутренних кровотечений, которые являются частым осложнением основного заболевания. Развитие анемии при хронической кровопотере отмечается в тех случаях, когда имеется скрытый источник незначительного кровотечения. Например, при колоректальном раке кровь может выделяться с калом незаметно для пациента. У всех пациентов с новообразованиями ЖКТ, у которых по клиническим и лабораторным проявлениям можно заподозрить скрытое желудочно-кишечное кровотечение, рекомендуется исследование кала на скрытую кровь и, если потребуется, инструментальные исследования для уточнения и остановки источника кровотечения39,40.



Недостаток железа и витаминов у онкологических пациентов связан с несколькими причинами: существенное влияние на баланс железа и связанный с ним нутритивный статус пациента оказывают системное противоопухолевое лечение и его переносимость.



Кроме того, у пациентов с новообразованиями в ЖКТ происходит снижение всасывания железа вследствие самого заболевания и связанного с ним воспалительного процесса, а также из-за хирургического вмешательства. Все это, в свою очередь, приводит к нарушению включения железа в эритропоэз и развитию железодефицитных состояний.
В комплексном систематическом обзоре, где анализировалось 60 исследований, посвященных оценке выживаемости, у онкологических пациентов с анемией наблюдалось общее увеличение риска смертности на 65% по сравнению с пациентами без анемии. Этот показатель варьировал от 19% у пациентов с опухолями легких до почти 75% у пациентов со злокачественными опухолями головы и шеи или лимфомой43. Влияние анемии на выживаемость было сопряжено с задержкой начала или неполным выполнением режима химиотерапии. Также при анемии наблюдается более слабый ответ на противоопухолевую терапию, поскольку для реализации цитотоксичности, достигаемой под действием лучевой терапии (ЛТ) и некоторых химиотерапевтических препаратов, требуется поддержание достаточного уровня кислорода в тканях. Кроме того, снижение кислородотранспортной способности крови (O2) может способствовать внутриопухолевой гипоксии с активацией индуцируемых гипоксией факторов (ИГФ, HIF). Действительно, ИГФ считаются главными регуляторами прогрессирования злокачественных опухолей44,47, поскольку регулируют активацию генов-мишеней, участвующих в ангиогенезе, уклонении от иммунитета и метаболическом перепрограммировании злокачественных клеток48, что делает их устойчивыми к ХТ и ЛТ49,50.


Анемия при злокачественных опухолях может сопровождаться широким спектром симптомов в зависимости от степени тяжести и скорости развития. Повышенная утомляемость является самым значимым симптомом53,54, затем следуют снижение умственных способностей, спутанность сознания и депрессия, особенно у пожилых людей. Также могут возникать тошнота, потеря аппетита, одышка, обмороки и падения, особенно у пациентов с сопутствующими заболеваниями, например сердца, легких и почек. Следует отметить, что снижение качества жизни (КЖ) становится особенно заметным при снижении уровня Hb до 11,5–10 г/дл, что классически рассматривается как легкая анемия и большинством врачей не воспринимается как значимая проблема55,56.


Согласно данным исследования Vogelzang N. J., которое оценивало усталость у онкологических пациентов, прошедших курс химио- или лучевой терапии, оказалось, что усталость оказывает влияние на различные аспекты повседневной жизни онкологических больных. Усталость определялась как общее чувство изнурительной усталости или потери энергии в процессе лечения или заболевания57.

Важным аспектом является тот факт, что усталость утяжеляет состояние онкологических пациентов более значимо для них, чем боль.

НАЛИЧИЕ АНЕМИИ НЕГАТИВНО ВЛИЯЕТ НА КАЧЕСТВО ЖИЗНИ, ПОЭТОМУ КРАЙНЕ ВАЖНО СВОЕВРЕМЕННО ДИАГНОСТИРОВАТЬ И НАЧАТЬ КОРРЕКЦИЮ АНЕМИИ58.
Результаты исследования (CAMARA 2020 год) подчеркивают важность поддерживающей терапии внутривенными препаратами железа, включая исследование обмена железа в онкологии. И свидетельствуют, что ферротерапия ДЖ и ЖДА позволяет улучшить качество жизни и функциональные возможности у онкологических больных на долгосрочной основе59.
В онкохирургии анемия может диагностироваться на любом этапе лечения: предоперационная — анемия хронического заболевания, опухоль-индуцированная; интраоперационная — связанная с кровопотерей во время операции, и послеоперационная, обусловленная проявлениями как предоперационной, так и интраоперационной анемии.



Предоперационная анемия — независимый фактор риска послеоперационной летальности63-68 и ассоциируется с ее ростом при всех оперативных вмешательствах. Согласно данным различных исследований, существует устойчивая тенденция к увеличению риска послеоперационной смертности в 1–3 раза63-68.

Предоперационная анемия может также привести к росту использования ресурсов здравоохранения из-за увеличения продолжительности нахождения в стационаре, повторных госпитализаций и рецидивов заболевания. У больных с железодефицитной анемией существует повышенный риск неблагоприятных послеоперационных исходов по сравнению с пациентами без анемии69-72.
Ряд исследований продемонстрировал отрицательное влияние предоперационной анемии на общую выживаемость73,74.
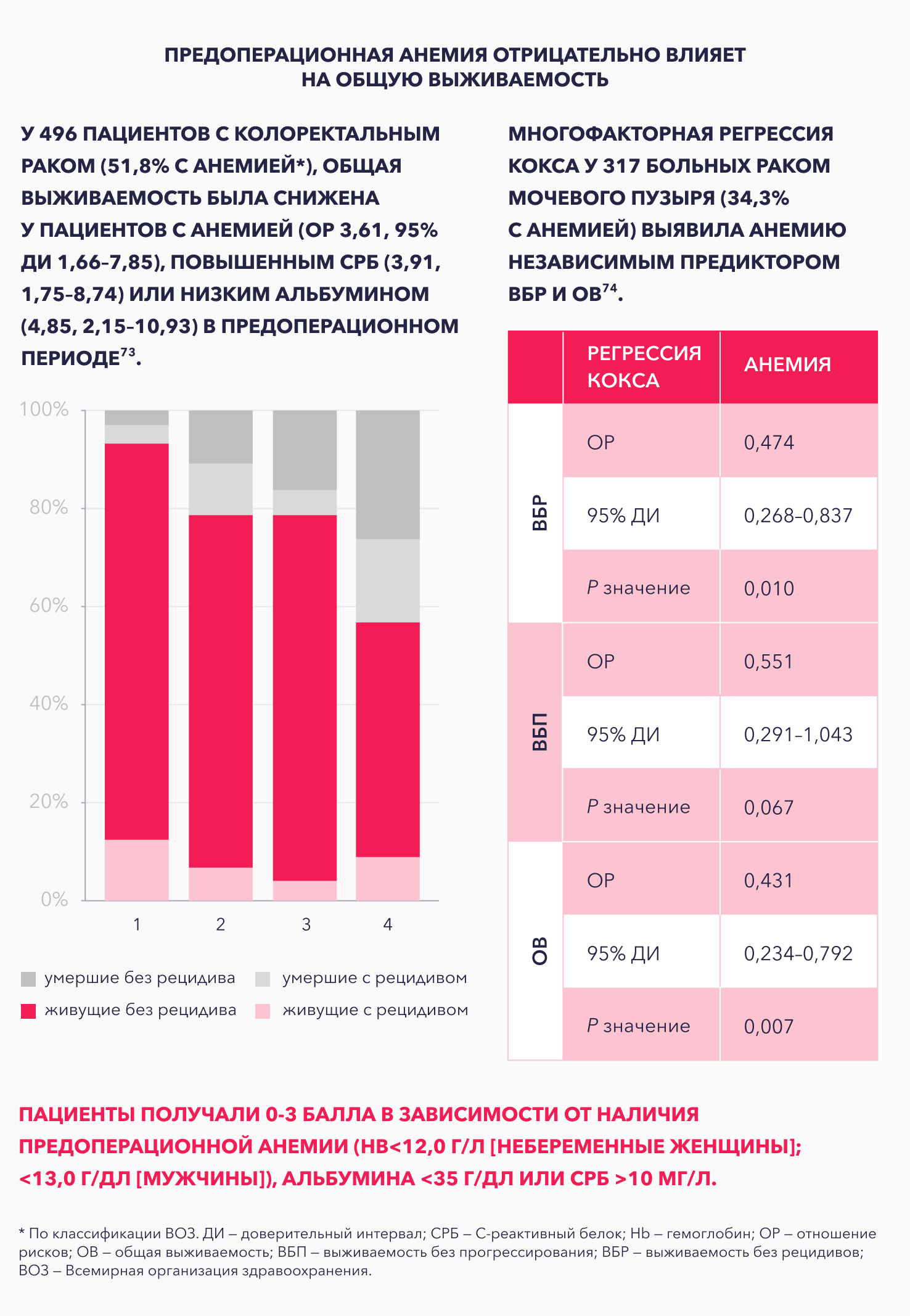
Особую группу пациентов составляют больные, которым предстоит хирургическое лечение по поводу опухолей абдоминальной локализации75,76. Дефицит железа и железодефицитная анемия у них встречаются в 33–48% случаев.
Рак толстого кишечника также часто осложняется дефицитом железа / железодефицитной анемией77, частота встречаемости которой у данной группы пациентов при выписке составляет 80%78.
Предоперационная анемия у пациентов с последующей открытой или лапароскопической гемиколэктомией является независимым предиктором нежелательных событий, включающим инфаркт миокарда, инсульт, прогрессивную почечную недостаточность или смерть в течение 30 дней после операции или увеличенную продолжительность госпитализации79 в связи с ростом послеоперационных осложнений80.
Данные последних исследований (Ryuma Tokunaga et al. 2019 г.) подтверждают, что предоперационная анемия, особенно микроцитарная анемия, сопряжена с неблагоприятными показателями результатов лечения пациентов с КРР (более низкие показатели общей и безрецидивной выживаемости), а периоперационные гемотрансфузии не приводят к желаемым результатам81.
Кровопотери, которые наблюдаются в процессе оперативных вмешательств, часто требуют проведения гемотрансфузий.

Следует учитывать тот факт, что периоперационные гемотрансфузии оказывают негативное влияние на показатели выживаемости у онкологических пациентов после проведенного хирургического лечения82-86.

Несмотря на то, что трансфузия эритроцитсодержащих компонентов крови в большинстве случаев позволяет быстро улучшить показатели гемоглобина, в 1–3% случаев после гемотрансфузий возникают нежелательные реакции88. В число таких реакций входят тромбозы, инфекции, иммунологические нарушения, острое повреждение легких, связанное с гемотрансфузией, аллергические реакции и образование антител к человеческому лейкоцитарному антигену. Гемодинамические и гематологические последствия, связанные с увеличением количества эритроцитов, включают артериальную гипертензию, трансфузионную циркуляторную перегрузку, а также снижение кровотока в почках и головном мозге89.

ПЕРЕЛИВАНИЕ КОМПОНЕНТОВ КРОВИ В КРАТКОСРОЧНОЙ ПЕРСПЕКТИВЕ ПОВЫШАЕТ КОНЦЕНТРАЦИЮ HB, НО НЕ УСТРАНЯЕТ ОСНОВНУЮ ПРИЧИНУ АНЕМИИ И ПОЭТОМУ НЕ ПОДХОДИТ ДЛЯ ЛЕЧЕНИЯ ХРОНИЧЕСКОЙ АНЕМИИ82.
ГТ — гемотрансфузии
Диагностика анемии при злокачественных новообразованиях (АЗН)
При сборе анамнеза у больных с анемией необходимо оценить1:

Лабораторная диагностика включает проведение ОАК, оценку показателей обмена железа. В зависимости от клинической ситуации могут быть применены дополнительные методы обследования.






Крайне важно для диагностики ЖДА определить ферритин и НТЖ90



Дефицит железа можно рассматривать как состояние, диагностируемое по результатам оценки целого спектра лабораторных показателей обмена железа. При крайней степени абсолютного дефицита железа (ферритин <30 нг/мл или насыщение трансферрина (КНТЖ) <20% ожидается, что пациенты ответят на монотерапию препаратом железа.

Накопленные к настоящему времени научные данные привели к существенным изменениям в подходах к лечению железодефицитной анемии, отраженным в современных международных и российских клинических рекомендациях.



Длительность терапии рассчитывается индивидуально с учетом возраста, массы тела пациента и степени дефицита железа92.
Пероральный прием препаратов железа является терапией выбора для бессимптомных пациентов или пациентов с легкой выраженностью симптомов функционального дефицита железа (ФДЖ) или анемией хронического заболевания, у которых нет признаков клинического или субклинического воспаления93,94.
Пероральные препараты железа могут быть неэффективными при лечении ФДЖ любой этиологии, поскольку поступившее перорально железо может быть секвестрировано в энтероцитах и недоступно для эритропоэза, и внутривенные препараты железа должны быть эффективными с точки зрения преодоления желудочно-кишечной и макрофагальной «блокады» при ФДЖ.





БОЛЕЕ ПОДРОБНО ИНФОРМАЦИЯ О ПРИМЕНЕНИИ ПРЕПАРАТА ЖЕЛЕЗА КАРБОКСИМАЛЬТОЗАТ БУДЕТ ПРЕДСТАВЛЕНА В РАЗДЕЛЕ «ИССЛЕДОВАНИЯ ЖКМ У ПАЦИЕНТОВ С ОНКОЛОГИЧЕСКИМИ ЗАБОЛЕВАНИЯМИ».
Согласно рекомендациям RUSSCO 2022 г., показателями нарушения обмена железа являются содержание сывороточного ферритина <100 нг/мл и насыщение железом сывороточного трансферрина <20%1.
Алгоритм лечения анемии у онкологических больных согласно рекомендациям RUSSCO представлен на рисунке ниже.

- Содержание сывороточного ферритина <100 нг/мл у онкологического больного свидетельствует об абсолютном дефиците железа и необходимости терапии препаратами железа; предпочтительны в/в лекарственные формы, т. к. при приеме внутрь железо плохо всасывается.
- Более высокое содержание сывороточного ферритина (100–800 нг/мл) и насыщение железом сывороточного трансферрина <20% свидетельствует о функциональном дефиците железа.
У БОЛЬНЫХ С АНЕМИЕЙ И ДЕФИЦИТОМ ЖЕЛЕЗА ПАРЕНТЕРАЛЬНОЕ ВВЕДЕНИЕ ПРЕПАРАТОВ ЖЕЛЕЗА ПРИВОДИТ К ЗНАЧИТЕЛЬНО БОЛЬШЕМУ ПОВЫШЕНИЮ КОНЦЕНТРАЦИИ HB, ЧЕМ БЕЗ ПРИМЕНЕНИЯ ЖЕЛЕЗОСОДЕРЖАЩИХ ПРЕПАРАТОВ ИЛИ ПРИ НАЗНАЧЕНИИ ПРЕПАРАТОВ ЖЕЛЕЗА ВНУТРЬ.
Поддержка препаратами железа уменьшает также число больных, нуждающихся в трансфузиях эритроцитов.
Алгоритм лечения анемии у онкологических больных согласно рекомендациям RUSSCO представлен на рисунке ниже.

Резюме1,97:

Эффективность и безопасность препарата железа карбоксимальтозат изучались в разных терапевтических областях, требующих внутривенного введения препаратов железа для устранения его дефицита. Результаты показали, что препарат железа карбоксимальтозат быстро улучшает уровень гемоглобина (Hb) и восполняет истощенные запасы железа в различных популяциях пациентов с железодефицитной анемией98.
У пациентов с ЗНО было проведено несколько клинических исследований, которые продемонстрировали хороший гемопоэтический ответ на терапию железа карбоксимальтозатом у пациентов с ЖДА, индуцированной химиотерапией99-101.
Название публикации: «Клинический опыт применения железа карбоксимальтозата в онкологии при лечении анемии, вызванной химиотерапией»99.

Краткое изложение и выводы:
Авторы исследования оценили эффективность и безопасность внутривенного введения железа карбоксимальтозата в рутинной практике у онкологических пациентов с анемией и дефицитом железа. В данное исследование были включены взрослые (старше 18 лет) пациенты с активным злокачественным новообразованием и абсолютным или функциональным дефицитом железа, которые были подтверждены лабораторно. Результаты предоставили 68 центров Германии. Пациенты получали препарат для внутривенного введения — железа карбоксимальтозат (ЖКМ) или ЖКМ + эритропоэз- стимулирующий препарат (ЭПО).
Дозы препарата железа, частота дозирования, использование ЭПО или гемотрасфузия, а также частота визитов во время исследования были оставлены на усмотрение исследователя в рамках обычной клинической практики.
Первый день лечения ЖКМ был определен как исходный, а период наблюдения составил 12 недель.
Профиль безопасности ЖКМ оценивался у всех пациентов, которые получили хотя бы 1 дозу лекарственного препарата.
Эффективность терапии оценивалась у всех пациентов, которым было определено исходное значение Hb (оценка производилась за 7 дней до получения ЖКМ и через 3 дня после первого введения ЖКМ для более точной верификации. Hb≠≥12 г/дл для женщин и ≥13 г/дл для мужчин расценивали как норму и не включали в исследование). В качестве критерия эффективности оценивался прирост Hb к концу исследования (12 недель) или на момент визита после окончания исследования (14 недель).
В общей сложности 354 (60,2%) пациента завершили 12-недельный период наблюдения и у них была произведена оценка профиля безопасности. ЖКМ в дозировке 600–1500 мг хорошо переносился. Нежелательные явления (НЯ) были зарегистрированы для всего 14 (2,3%) пациентов. В основном они были связаны с желудочно-кишечным трактом (тошнота и диарея). В опросе, оценивающем удовлетворенность лечением ЖКМ, оценку «очень хорошо» или «хорошо» по критериям эффективности и переносимости дали 97,4% и 81,0% соответственно из 390 ответивших исследователей. Кроме того, 81,5% планировали снова применить ЖКМ для коррекции железодефицитных состояний у своих пациентов при необходимости.
Результаты:
Результаты исследования показали, что медиана общей дозы ЖКМ составила 1000 мг (600–1500 мг). Медиана увеличения уровня Hb была сопоставима у пациентов, которые получали только ЖКМ (1,4 г/дл [0,2–2,3 г/дл; N= 233]), и у пациентов, которые получали ЖКМ+ЭПО (1,6 г/дл [0,7–2,4 г/дл; N= 46]). Эффект от лечения анемии препаратом ЖКМ был более выражен у пациентов с исходным уровнем Hb до 11,0 г/дл и сывороточным ферритином (СФ) до 500 нг/мл (стабильный уровень Hb ≥11,0 г/дл) и у группы пациентов, у которых СФ >500 нг/мл при низких значениях КНТЖ.
Показатели безопасности:
Железа карбоксимальтозат хорошо переносился. Сообщения о НЯ были у 2,3% пациентов в основном со стороны ЖКТ.
Заключение:
Значительное повышение уровня Hb и его стабилизация на уровне 11–12 г/дл позволяет применять ЖКМ в качестве монотерапии ЖДА у онкологических пациентов.
Название публикации: «Лечение анемии внутривенным введением железа карбоксимальтозата без стимуляторов эритропоэза у онкологических больных, получающих химиотерапевтическое лечение».

Краткое изложение и выводы:
В связи с нежелательными явлениями эритропоэз-стимулирующих препаратов и предполагаемым их негативным влиянием на прогрессирование заболевания и выживаемость онкологических пациентов, авторы исследования решили оценить эффективность и безопасность внутривенного введения железа карбоксимальтозата у больных с анемией злокачественных новообразований (ЗНО), получающих химиотерапию (ХТ).
В исследование были включены пациенты с ЗНО старше 18 лет, которые должны были начать курс химиотерапии или лучевой терапии через неделю после начала исследования и имели уровень гемоглобина (Hb) 11,0 г/дл. Ожидаемая продолжительность жизни пациентов — более 24 недель, статус ECOG — 0–2. Пациенты не должны были получать ЭПО или препараты железа в течение 30 дней до включения в исследование.
На основании показателей ферритина сыворотки крови (sFr) и коэффициента насыщения трансферрина железом (КНТЖ) больные были разделены на 3 группы: I группа (абсолютный дефицит железа, n=26) с sFr<30 нг/мл и КНТЖ<20%; II группа (функциональный дефицит железа, n=24) с sFr 30–800 нг/мл и КНТЖ<20%; а пациенты с КНТЖ 20% были отнесены к III группе — «другие» (n=34).
Всем пациентам проводилась внутривенная терапия ЖКМ.
Уровень гепсидина сыворотки крови и С-реактивный белок были использованы в качестве биомаркеров для прогнозирования ответа.
Всего было набрано 84 пациента (средний возраст 53,8 лет (10,6). Базовый уровень и средний уровень гемоглобина составляли 10,2 г/дл (диапазон: 8,3–11,0).
Уровень Hb проверяли каждые 3 недели, в основном в соответствии с протоколом запланированной химиотерапии, а затем на 12-й неделе.
На 12-й неделе произошел значительный прирост уровня Hb у пациентов в группах I и II (медиана прироста: 2,35 и 1,5 г/дл соответственно), с ограниченным ответом, наблюдаемым в группе III. Самый большой прирост Hb отмечен на 3-й неделе (1,0 г/дл). Респонденты, как правило, имели более низкие уровни гепсидина.
Авторы исследования пришли к заключению, что ЖКМ безопасен и эффективен при лечении ЖДА у пациентов с ЗНО, которые находятся на ХТ. Пациенты с ЖДА и низким уровнем гепсидина имеют более высокую частоту ответов на терапию ЖКМ.

Название публикации: «Железа карбоксимальтозат в лечении анемии, вызванной химиотерапией — эффективная, безопасная и экономичная альтернатива переливанию компонентов крови1».

Краткое изложение и выводы:
Это исследование было направлено на оценку клинической и экономической эффективности железа карбоксимальтозата на коррекцию анемии, вызванной химиотерапией.
Данное исследование продолжалось с 2015 по 2016 г. В него были включены 99 пациентов с солидными опухолями, которые получали химиотерапию и имели подтвержденную лабораторно железодефицитную анемию ≥2 степени тяжести.
Оценка ответа на терапию препаратом железа карбоксимальтозат проводилась через 4 недели после начала лечения.
У всех онкологических пациентов, находящихся на амбулаторном лечении в период с 2015 по 2016 г., оценивали частоту гемотрансфузий, сравнение проводилось с ретроспективной когортой пациентов (2013–2014 гг.), получившей только переливание компонентов крови. В период с 2015 по 2016 г. 99 пациентов были включены в исследование и получали железа карбоксимальтозат, большинство из них (n=81) имели дефицит железа. Средние концентрации уровня гемоглобина повысились с 9,2 [6,7–10,8] г/дл до 10,6 [7,8–14,2] г/дл через четыре недели после лечения. Также наблюдалось снижение случаев переливания компонентов крови на 26% по сравнению с группой контроля (ОР 0,74 (95% ДИ: 0,66–0,83, р<0,0001).
Анализ затрат показал выгоду от применения железа карбоксимальтозата при анемии, вызванной химиотерапией.
Это исследование показывает, что железа карбоксимальтозат является эффективным и экономичным лечением железодефицитной анемии, снижающим потребность в гемотрансфузиях, экономя препараты крови, которые являются ограниченным ресурсом здравоохранения.




В хирургической практике в РКИ было показано, что применение препарата железа карбоксимальтозат сокращает количество переливаний эритроцитсодержащих компонентов крови, уменьшает продолжительность пребывания пациентов в стационаре и связано с сокращением числа повторных госпитализаций1-3.
Название публикации: «Железа карбоксимальтозат снижает количество гемотрансфузий и продолжительность пребывания в стационаре у пациентов с раком толстой кишки и анемией102».


Данное многоцентровое наблюдательное исследование включало 2 последовательные группы пациентов с анемией (в соответствии с критериями ВОЗ). Пациенты в группе «без внутривенного введения железа» (n=155) получали стандартное лечение, а пациенты в группе внутривенного введения железа получали ЖКМ (n=111) за 2–4 недели до операции (средняя доза 1000 мг). Группа лечения «без внутривенного введения железа» была статистически обработана ретроспективно, а пациенты, получавшие лечение препаратом железа карбоксимальтозат, наблюдались проспективно. Оценка показателей проводилась за 2–4 недели до операции и через 30 дней после хирургического лечения.
Исследование показало, что предоперационное лечение анемии у пациентов, страдающих раком толстого кишечника, с применением препарата железа карбоксимальтозат на 28,8% снижает количество необходимых трансфузий эритроцитов по сравнению с группой пациентов, получавших лечение пероральными препаратами железа (9,9% в сравнении с 38,7% соответственно, Р<0,0001). Несмотря на более низкие показатели Hb на исходном уровне и снижение необходимых гемотрансфузий, доля ответивших на терапию как при поступлении в стационар (48,1% против 20% соответственно, Р<0,0001), так и через 30 дней после операции (80% против 48,9%, Р<0,0001) при применении ЖКМ была значительно выше, по сравнению с группой без в/в железа. Внутривенное введение ЖКМ сопровождалось быстрым и стойким увеличением уровня Hb по сравнению с группой терапии пероральным препаратом железа. Также при применении ЖКМ было меньше повторных вмешательств и послеоперационных осложнений (20,7% против 26,5%, Р=0,3).
Продолжительность госпитализации при в/в введении ЖКМ составила 8,4±6,8 дня, без в/в железа — 10,9 ± 12,4 дня до выписки (Р<0,0001).
Заключение:
Предоперационное лечение препаратом железа карбоксимальтозат пациентов с раком толстой кишки и железодефицитной анемией значительно сократило потребность в гемотрансфузиях и пребывание в стационаре, обеспечив высокую частоту гематологического ответа и нормализацию уровня Hb как на момент госпитализации, так и через 30 дней после операции.
Основываясь на снижении количества гемотрансфузий и продолжительности пребывания в стационаре, можно предположить, что предоперационное введение железа карбоксимальтозата пациентам с раком толстой кишки и железодефицитной анемией, которым требуется хирургическое вмешательство, может привести к значительной экономии бюджета здравоохранения.






Название публикации: «Возможность применения и клиническая эффективность внутривенного введения железа при предоперационной анемии у пациентов с колоректальным раком103».


Исследование реальной клинической практики, в котором принимали участие 20 пациентов с железодефицитной анемией при КРР за 14 дней до запланированной даты операции. Период наблюдения составил 2 недели.
В данном исследовании оценивалась возможность введения однократной 15-минутной инфузии внутривенного введения препарата железа (железа карбоксимальтозат) в амбулаторных условиях, сравнимой с предоперационной оценкой в рамках ограничений целевого времени очереди на операцию. Кроме того, рассматривались дополнительные показатели эффективности терапии ЖКМ, такие как: влияние внутривенной инфузии препарата железа карбоксимальтозат на повышение уровня Hb и снижение гемотрансфузий; выявление потенциальных предикторов ответа на терапию и методов отбора кандидатов на лечение; показатели безопасности.
Результаты исследования:
Наблюдалось значительное повышение медианы уровня гемоглобина (Hb) от момента в/в введения препарата ЖКМ до дня начала операции на 1,8 г/дл [межквартильный диапазон (IQR) 0,75–2,45, р<0,001] для всей когорты. Двум пациентам была проведена гемотрансфузия перед операцией, остальным пациентам (n=18) это не потребовалось. Повышение уровня гемоглобина оставалось стабильным (р<0,001, медиана — 1,65 г/дл, IQR 0,5–2,3). Пациенты, которые ответили на терапию в/в препаратом ЖКМ, имели более высокий уровень эритропоэтина (р<0,01), более низкие значения Hb при включении в исследование, КНТЖ и С-реактивного белка (р<0,05). Показатели до включения в исследования: Hb (Rs=-0,62, р<0,01), уровень КНТЖ (Rsс=-0,67, р<0,01) и эритропоэтина (Rs=0,69, p<0,01) коррелирует с величиной изменения уровня гемоглобина в результате лечения. Пяти пациентам была проведена гемотрансфузия до четвертого послеоперационного дня, что было значительно меньше, чем изначально предполагалось (р<0,05). НЯ зарегистрировано не было.
Заключение:
Внутривенное введение железа карбоксимальтозата является важным методом предоперационной подготовки пациента с колоректальным раком и анемией. Введение железа карбоксимальтозата в предоперационном периоде приводит к повышению уровня гемоглобина и сокращению периоперационных гемотрансфузий.



Название публикации: «Предоперационное лечение железодефицитной анемии у пациентов с раком толстой кишки препаратами железа для внутривенного введения уменьшает число послеоперационных осложнений и частоту анемии103».


Данное ретроспективное моноцентровое исследование проводилось с 2017 по 2018 г. c участием 549 пациентов с КРР, которым предстояло хирургическое лечение. Пациенты были разделены на 2 группы: первая группа — с предоперационной анемией, пациенты получали ЖКМ (n=180) в дозировке 500 или 1000 мг до оперативного лечения, и вторая группа — без терапии ЖКМ (n=138). 231 пациент без анемии и лица, нуждавшиеся в срочной операции, были исключены из анализа данных.
Задачи исследования:
Определить влияние предоперационной терапии препаратами железа на трансфузии ЭСК крови, послеоперационные осложнения и продолжительность пребывания в стационаре среди пациентов, страдающих раком толстой кишки, перенесших резекцию толстой кишки.
В группе ЖКМ у 22,8% пациентов выполнены либо интра-, либо послеоперационные трансфузии ЭСК, в контрольной группе — у 31,9% пациентов (р=0,07, ОШ 0,63, 95% ДИ 0,38–1,04).
Заключение:
Предоперационная терапия внутривенными препаратами железа (ЖКМ) у пациентов с раком толстой кишки и ЖДА способствовала:
- значительному снижению послеоперационных осложнений;
- уменьшению частоты послеоперационной анемии, которая нередко затрудняет восстановление пациентов.
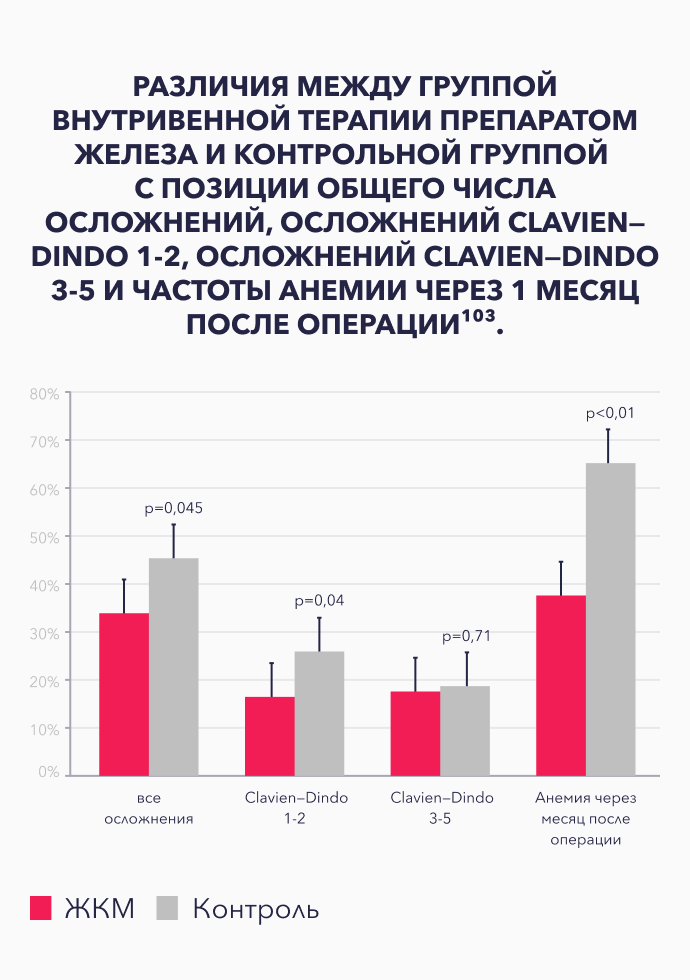
Различия между группой внутривенной терапии препаратом железа и контрольной группой с позиции общего числа осложнений, осложнений Clavien—Dindo 1-2, осложнений Clavien—Dindo 3-5 и чаcтоты анемии через 1 месяц после операции103.


Резюме102-104:
- периоперационная анемия негативно влияет на исход лечения;
- восстановление запасов железа возможно только внутривенным введением препаратов железа;
- у отдельных пациентов хирургическое вмешательство может быть отложено, чтобы усилить влияние внутривенного введения железа на нормализацию уровня Hb.
- Рабочая группа RUSSCO по поддерживающей терапии. Практические рекомендации. Версия 2022 г.
- Кулибаба Т. Г., Пчелин И. Ю., Слепых Л. А. Особенности анемического синдрома у онкологических пациентов / Juvenis scientia. 2018; №9 / DOI: 10.32415/jscientia.2018.09.02
- Бредер В., Горбунова В. А., Бесова Н. С. Анемия при злокачественных опухолях. Москва: Российский онкологический научный центр им. Н. Н. Блохина РАМН, 2003.
- Cappelini M. D., et al. Am L Hematol, 2017;92:1068–1078.
- МЗ РФ. Клинические рекомендации. Анемия при злокачественных новообразованиях (2020 г.). http://www.consultant.ru
- Dicato M., et al. Annals of Oncology 2010;21:vii167–vii172.
- Ludwig H., et al. Support Care Cancer (2014) 22:2197–2206.
- Hairong Xu, et al. Incidence of anemia in patients diagnosed with solid tumors receiving chemotherapy, 2010–2013 / Clinical Epidemiology, 2016. DOI: 10.2147/CLEP.S89480
- Luporsi E., et al. BMJ Supportive & Palliative Care 2021;0:1–7. doi:10.1136/bmjspcare-2021-002913
- Снеговой А. В., Ларионова В. Б., Манзюк Л. В., Кононенко И. Б. Анемии в онкологии: современные возможности поддерживающей терапии / Клиническая онкогематология. 2016;9(3):326–35.
- Schwartz R. N. Am J Health Syst Pharm 2007;64:S5-13, quiz S28-30.
- Steensma D. P. J Clin Oncol 26:1022–1024.
- Wilson J., Yao G. L., Raffery J., et al. Health Technol Assess 2007;11:1–202, iii-iv.
- NCCN (National Comprehensive Cancer Network) Clinical Practice Guidelines in Oncology, Cancer- and chemotherapy-induced anemia. V3 2009.
- Munoz et al. World J Gastroentrol. 2009, 5(37), 4617–4626.
- Wehkamp J., et al. Nat Clin Gastroenterol Hepatol. 2005;2:406–415. Reprinted by permission from Macmillan Publishers Ltd.
- Ganz T. Physiol Rev. 2013;93:1721–1741. Reprinted with permission by The American Physiological Society.
- Nemeth E, et al. Science. 2004;306:2090–2093.
- Phipps O., et al. Iron deficiency, immunology, and colorectal cancer.2020.doi: 10.1093/nutrit/nuaa040
- Adamson J. W. Hematology 2008:159–165.
- Birgegard G., Aapro M. S., Bokemeyer C., et al. Oncology 2005;68(Suppl 1)3-11.
- Grotto HZW. Med Oncol 2008;25:12–21.
- Weiss G., Goodnough L. T. N. Engl J Med 2005;352:1011–11.
- Auerbach M., Ballard H., Trout J. R., et al. J Clin Oncol 2004;22:1301–1307.
- Bastit L., Vandenbroek A., Altintas S., et al. J Clin Oncol 2008;26:1611–1618.
- Pedrazzoli P., Farris A., Del Prete S., et al. J Clin Oncol 2008;26:1619–1625.
- Henry D. H., Dahl N. V., Auerbach M., et al. The Oncologist 2007;12:231–242.
- Hedenus M., Birgegard G., Nasman P., et al. Leukemia 2007;21:627–632.
- Bamias A., Aravantinos G., Kalofonos C., et al. Prevention of anemia in patients with solid tumors receiving platinum-based chemotherapy by recombinant human Erythropoietin (rHuEpo): a prospective, open label, randomized trial by the Hellenic Cooperative Oncology Group. Oncology. 2003;64(2):102–110.
- Dicato еt al. Annals of Oncology 2010;21:67–72.
- Clarke H., Pallister C. J. The impact of anaemia on outcome in cancer. Clin Lab Haematol. 2005;27(1):1–13.
- Pivot X., Guardiola E., Etienne M., et al. An analysis of potential factors allowing an individual prediction of cisplatin-induced anaemia. Eur J Cancer. 2000;36(7):852–857.
- Spivak J. L., Gascón P., Ludwig H. Anemia management in oncology and hematology. Oncologist. 2009;14(Suppl 1):43–56.
- Rothmann S. A., Paul P., Weick J. K., Mcintyre W. R., Fantelli F. Effect of cis-diamminedichloroplatinum on erythropoietin production and hematopoietic progenitor cells. Int J Cell Cloning. 1985;3(6):415–423.
- Groopman J. E., Itri LM. Chemotherapy-induced anemia in adults: incidence and treatment. J Natl Cancer Inst. 1999;91(19):1616–1634.
- Reitan J. F., Kudrik F. J., Fox K., van Breda A., Shreay S., Corey-Lisle P. K. The burden of blood transfusion: a utilization and economic analysis — a pilot study in patients with chemotherapy-induced anemia (CIA). J Med Econ. 2013;16(5):633–638.
- Barni, et al. The Oncologist 2012;17:715–724.
- МЗ РФ. Клинические рекомендации. Анемия при злокачественных новообразованиях (2020 г.). http://www.consultant.ru
- Beale A. L., Penney M. D., Allison M. C. The prevalence of iron deficiency among patients presenting with colorectal cancer. Colorectal. Dis. 2005; 7:398–402.
- Птушкин В. В. Клиническая онкогематология. Т. 6. №1. 2013.
- Kewan T., et al. European Journal of Cancer 137 (2020) 285–287. https://doi.org/10.1016/j.ejca.2020.07.005
- Костюченко Л. Н. и соавт. Железодефицитные синдромы в клинической онкологии и их коррекция препаратами нутритивного действия. DOI: 10.33667/2078–5631–2019–2–13(388)-20–25.
- Caro, J. J., Salas, M., Ward, A., Goss, G. Anemia as an independent prognostic factor for survival in patients with cancer: A systemic, quantitative review. Cancer 2001, 91, 2214–2221.
- Schito L., Semenza G.L. Hypoxia-inducible factors: Master regulators of cancer progression. Trends Cancer 2016, 2, 758–770.
- Deeb G., Vaughan M. M., McInnis I., Ford L. A., Sait S. N., Starostik P., Wetzler M., Mashtare T., Wang E. S. Hypoxia-inducible factor-1alpha protein expression is associated with poor survival in normal karyotype adult acute myeloid leukemia. Leuk. Res. 2011, 35, 579–584.
- Morine Y., Shimada M., Utsunomiya T., Imura S., Ikemoto T., Mori H., Hanaoka J., Kanamoto M., Iwahashi S., Miyake H. Hypoxia inducible factor expression in intrahepatic cholangiocarcinoma. Hepatogastroenterology 2011, 58, 1439–1444.
- Zheng S. S., Chen X. H., Yin X., Zhang B. H. Prognostic significance of hif-1alpha expression in hepatocellular carcinoma: A meta-analysis. PLoS ONE 2013, 8, e65753.
- Semenza G. L. Hif-1 and tumor progression: Pathophysiology and therapeutics. Trends Mol. Med. 2002, 8, S62–S67.
- Harrison L. B., Chadha M., Hill R. J., Hu K., Shasha D. Impact of tumor hypoxia and anemia on radiation therapy outcomes. Oncologist 2002, 7, 492–508.
- Vaupel P., Harrison L. Tumor hypoxia: Causative factors, compensatory mechanisms, and cellular response. Oncologist 2004, 9, 4–9.
- Новик А. В. Анемия и метаболические расстройства у онкологических больных. ФГУ НИИ онкологии им. Н. Н.Петрова, г. Санкт-Петербург. Практическая онкология.Т. 10, № 3 – 2009 (Электронный ресурс) 20.06.2020 https://www.practical-oncology.ru/articles/228.pdf
- Varlotto J., Stevenson M. Anemia, tumor hypoxemia, and the cancer patient. Int. J. Radiat. Oncol. Biol. Phys. 2005; 63 (1): 25–36.
- van Eeden R., Rapoport B. L. Current trends in the management of anaemia in solid tumours and haematological malignancies. Curr. Opin. Support Palliat. Care 2016, 10, 189–194.
- Harper P., Littlewood T. Anaemia of cancer: Impact on patient fatigue and long-term outcome. Oncology 2005, 69, 2–7.
- Crawford J., Cella D., Cleeland C. S., Cremieux P. Y., Demetri G. D., Sarokhan B. J., Slavin M. B., Glaspy J. A. Relationship between changes in hemoglobin level and quality of life during chemotherapy in anemic cancer patients receiving epoetin alfa therapy. Cancer 2002, 95, 888–895.
- Wright J. R., Ung Y. C., Julian J. A., et al. Randomized, double-blind, placebo-controlled trial of erythropoietin in non-small-cell lung cancer with disease-related anemia. J Clin Oncol. 2007;25(9):1027–1032.
- Vogelzang N. J., Breitbart W., Cella D., et al. Patient, caregiver, and oncologist perceptions of cancer-related fatigue: Results of a tripart assessment survey. Semin Oncol 1997;34(3, suppl 2):4–12.
- Barca-Hernando M., Muñoz-Martin A. J., Rios-Herranz, E., Garcia-Escobar I., Beato C., Font C., Oncala-Sibajas E., Revuelta-Rodriguez A., Areses M. C., Rivas-Jimenez, V.; et al. Case-Control Analysis of the Impact of Anemia on Quality of Life in Patients with Cancer: A Qca Study Analysis. Cancers 2021, 13, 2517. https:// doi.org/10.3390/cancers13112517
- Gluszak С. Annals of Oncology (2020) 31 (suppl_4): S988-S1017. 10.1016/annonc/annonc291
- Egenvall M., et al. Colorectal Dis 2018;20:26–34.
- Chen C., et al. Med Sci Monit 2017;23:3528–3535.
- Gregory M. T., Hare M. D., Ph.D., David Mazer C., Anesthesiology M.D., 2021, Vol.135, №3, P. 520–530.
- Musallam K., et al. Lancet 2011;378:1396–1407.
- Baron D. M., et al. Br J Anaesthesia 2014;113:416–423.
- Fowler A. J., et al. Br J Surg 2015;102:1314–1324.
- Dunne J. R., et al. J Surg Res 2002;102:237–244.
- Beattie W. S., et al. Anesthesiology 2009;110:574–581.
- Goobie S. M., et al. JAMA Pediatr 2016;170:855–862.
- Soria F., et al. Urol Oncol 2017;35:113.e9–113.e14.
- Xia L., et al. Anticancer Res 2017;37:3175–3181.
- Xia L., Guzzo T. J. Clin Genitourin Cancer 2017;15:263–272.
- Luo F., et al. PLoS One 2017;12:e0171701.
- Egenvall M., et al. Colorectal Dis 2018;20:26–34.
- Chen C., et al. Med Sci Monit 2017;23:3528–3535.
- Mörner MEM et al. Int J Colorectal Dis 2016; Oct 21 [Epub ahead of print].
- Yeh H.-C., et al. Urol Oncol 2016;34:337;e1–9.
- Calleja J. L., et al; Int J Colorectal Dis. 2016 Mar;31(3):543–51.
- Ristescu I., et al. Chirurgica 2019;114:234–242.
- Leichte S. W., et al. J Am Coll Surg. 2011;212:187–94.
- Wilson M. J., et al. Int J Colorect Dis 2017;32:1617–1624.
- Ryuma Tokunaga and al. The impact of preoperative anaemia and anaemic subtype on patient outcome in colorectal cancer. Colorectal Dis 2019 Jan;21(1):100–109. doi: 10.1111/codi.14425. Epub 2018 Oct 11./ doi: 10.1111/codi.14425
- NCCN (National Comprehensive Cancer Network) Clinical Practice Guidelines in Oncology, Cancer- and chemotherapy-induced anemia. V3 2009. http://www.nccn.org/professionals/physician_gls/PDF/anemia.pdf
- Allen H. J., Klein H. G. The hazards of blood transfusions in historical perspective. Blood 2008; 112:2617–2626.
- Khorana A. A., Francis C., Blumberg N., et al. Blood Transfusions, Thrombosis, and Mortality in Hospitalized Patients With Cancer. Arch Intern Med. 2008;168(21):2377–2381.
- Bennett-Guerrero E., Veldman T. H., Doctor A. et al. Proc. Natl. Acad. Sci USA. 2007; 104:1763–1768.
- Koch C. G., Li L., Sessler D. I., et al. NEJM. 2008; 358:1229–39.
- Kosumi K., et al. Dig Surg. 2015;32:445–53.
- McCullough J. J. Complications in transfusion. In: Transfusion Medicine. 3rd ed. Chichester, WestSussex, UK: Wiley-Blackwell; 2011.
- Spivak J. L., Gascón P., Ludwig H. Anemia management in oncology and hematology. Oncologist. 2009;14(Suppl 1):43–56.
- Cappellini M. D., et al. Am J Hematol. 2017;92:1068–1078.
- Camaschella C. New Engl J. Med. 2015;372:1832–1843.
- Tussing-Humphreys L., et al. J Acad Nutr Diet 2012;112(3):391–400.
- Национальное гематологическое общество. Национальное общество детских гематологов, онкологов. Клинические рекомендации. Железодефицитная анемия (2021 г.). https://cr.minzdrav.gov.ru/recomend/669_1
- Weiss G., and Goodnough L. T.: Anemia of chronic disease. N Engl J Med 352, 1011–1023, 2005.
- NCCN. Cancer- and Chemotherapy-Induced Anemia, Version 2.2014. http://www.nccn.org/professionals/ physician_gls/pdf/anemia.pdf (2014). Accessed 2015.
- Toblli J. E., and Angerosa M.: Optimizing iron delivery in the management of anemia: patient considerations and the role of ferric carboxy maltose. Drug Des Dev Ther 8, 2475–2491, 2014.
- Ludwig H., Evstatiev R., Kornek G., Aapro M., Bauernhofer T., et al. Iron metabolism and iron supplementation in cancer patients. Wien Klin Wochenschr 127, 907–919, 2015.
- Сакаева Д. Д. Анемия и дефицит железа у онкологических больных: роль внутривенных препаратов железа (обзор литературы). Современная онкология. 2022;24(4):468–476. DOI: 10.26442/18151434.2022.4.202018.
- Инструкция по медицинскому применению лекарственного препарата ЖКМ, раствор для внутривенного введения (50 мг/мл). ЛСР-008848/10_12.10.2020.
- Steinmetz T., Tschechne B., Harlin O., Klement B., Franzem M., Wamhoff J., Tesch H. et al. (2013) Clinical experience with ferric carboxymaltose in the treatment of cancer and chemotherapy asso-ciated anaemia. Ann Oncol 24:475–482M.
- Abdel-Razeq H., Saadeh S. S., et al. Ther Adv Med Oncol 2020, Vol. 12: 1–9 / Treatment of anemia in cancer patients undergoing chemotherapy with intravenous ferric carboxymaltose without erythropoiesis-stimulating agents. doi.org/10.1177/1758835920953292
- Joana Marinho et al. Ferric Carboxymaltose in the treatment of chemotherapy-induced anaemia: an efective, safe and cost-sparing alternative to blood transfusion.(2019) 9:20410. https://doi.org/10.1038/s41598-019-56999-3
- Calleja J. L., et al Int J Colorect Dis 2016;31:543–51.
- Keeler B. D., et al. Colorectal Dis 2014;16:794–800.
- Kangaspunta M., et al. Int J Colorectal Dis. 2021. doi.org/10.1007/s00384-021-04080-9.
