

Менструальный цикл представляет собой серию сложных гормональных событий, которые зависят от баланса функций гипоталамуса, гипофиза, яичников и матки. Нормальный менструальный цикл происходит каждые 21–35 дней и длится от 2 до 7 дней. В среднем женщины теряют от 30 до 80 мл менструальной крови в течение каждого цикла, причем большая часть этой потери происходит в течение первых 3 дней1.
Маточное кровотечение, которое отличается по количеству, продолжительности или частоте от стандартного маточного кровотечения, считается патологическим (аномальным)1.


Существуют разные способы измерения, определения и регистрации менструальной кровопотери. Количество менструальной кровопотери может быть измерено с помощью прокладки, тампона или путем оценки размера сгустков крови2.


Эпидемиологические исследования показывают, что до 30% женщин репродуктивного возраста страдают от обильных менструальных кровотечений. Распространенность значительно варьируется в зависимости от того, каким образом измеряется кровопотеря3,4.

Анемия присутствует примерно у 25% населения всего мира, наибольшее абсолютное число лиц с анемией составляют небеременные женщины5,6.

Fraser и cоавт. изучали распространенность тяжелых менструальных кровотечений среди населения Европы. Интернет-опрос проводился среди женщин (в возрасте от 18 до 57 лет) в пяти европейских странах в период с января по февраль 2012 года. Было установлено, что в общей сложности 1225 женщин испытали два или более тяжелых менструальных кровотечения в течение предшествующего года. Среди 330 женщин с тяжелым менструальным кровотечением, которые завершили детальное обследование, у 208 (или 63,0%) был также диагностирован дефицит железа или железодефицитная анемия7.



46% женщин, у которых возникало не менее двух тяжелых менструальных кровотечений, никогда не обращались к врачу по поводу этих симптомов. Кроме того, 31,1% женщин, которые все же обращались к врачу, сделали это спустя более года после появления этих симптомов7.




У женщин в пременопаузе из стран с высоким уровнем дохода на душу населения менструальная кровопотеря является наиболее распространенной причиной развития железодефицитной анемии8.
Оценки значительно варьируются, но считается, что тяжелое менструальное кровотечение является причиной 20-30% всех случаев железодефицитной анемии, и, учитывая, что тяжелые менструальные кровотечения возникают у 30% женщин репродуктивного возраста, можно констатировать, что данной патологией страдает значительная часть населения.
Кровопотеря является важной причиной развития дефицита железа и железодефицитной анемии, поскольку в каждом миллилитре потерянной крови содержится 0,5 мг железа8. У женщин с тяжелыми или продолжительными менструациями кровопотеря может достигать 400 мл в месяц, что соответствует потере железа в количестве приблизительно 200 мг9.

Может происходить увеличение абсорбции железа за счет компенсаторных механизмов, но эти механизмы не смогут восполнить недостаток, если потеря железа превышает 5 мг в день (или 150 мг в месяц). Такой дефицит железа приводит к уменьшению массы эритроцитов, что, в свою очередь, стимулирует эритропоэз и, следовательно, приводит к железодефицитной анемии8.
В некоторых случаях причина обильных менструальных кровотечений неизвестна, но обильные менструальные кровотечения могут возникать в результате ряда состояний10.
Частые причины ОМК:
- гормональный дисбаланс;
- дисфункция яичников;
- миома матки;
- полипы;
- аденомиоз;
- внутриматочная спираль;
- осложнения беременности;
- рак;
- наследственные нарушения свертываемости крови;
- лекарственные препараты;
- другие заболевания.
Факторы риска зависят от возраста и сопутствующих заболеваний. У девочек-подростков обильные менструальные кровотечения обычно связаны с ановуляцией, в то время как у женщин старшего репродуктивного возраста в основном из-за патологии матки10.

Дефицит железа и анемия у женщин с тяжелыми менструальными кровотечениями имеют ряд негативных последствий, в том числе:
По данным исследования Peuranpää и соавт., изучавших связь анемии и качества жизни, улучшение качества жизни связано с устранением анемии, и врачи должны рассматривать раннее начало восполнения дефицита железа как неотъемлемую часть лечения у женщин с тяжелыми менструальными кровотечениями11.
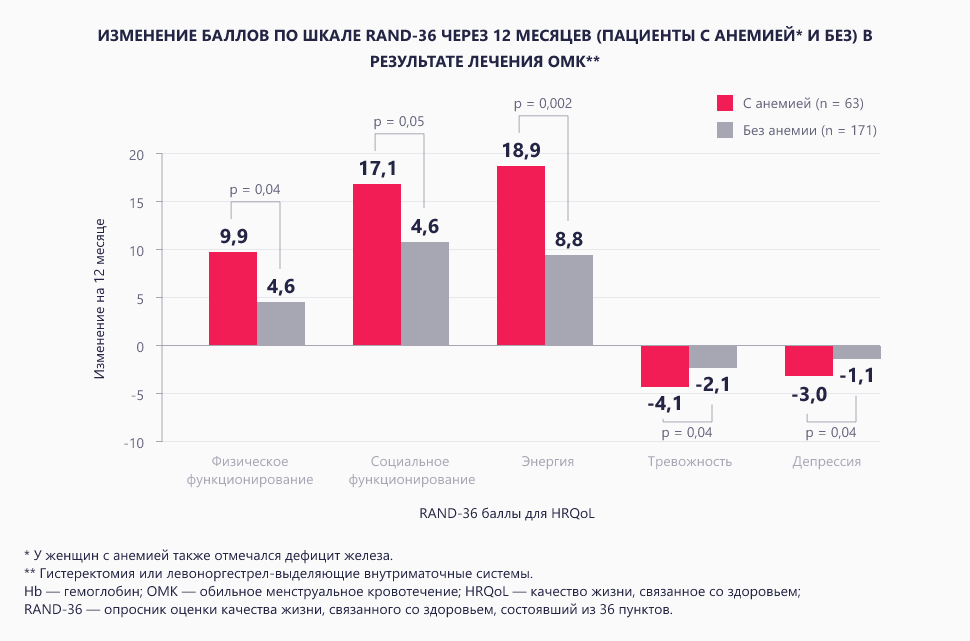
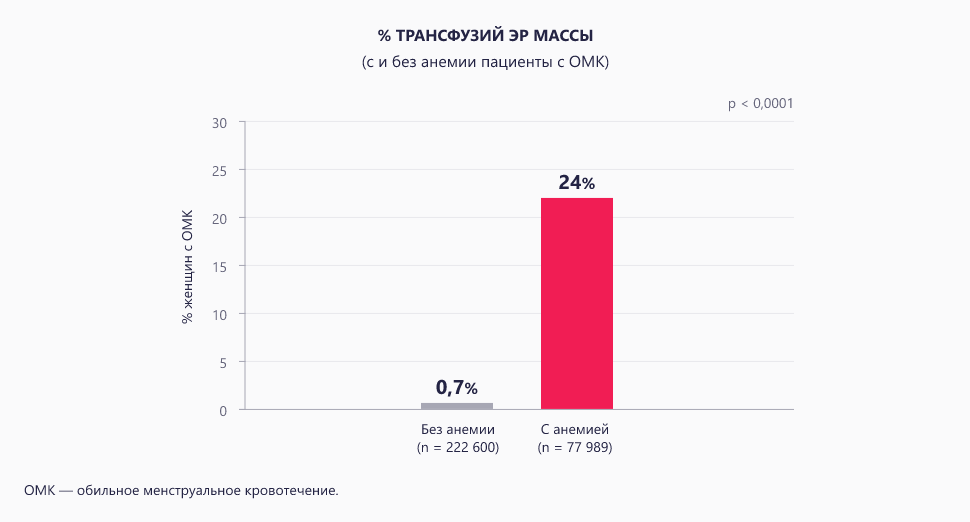
Важным выводом, который был сделан в ходе исследования Peuranpää и соавт., было то, что в ходе госпитализации 24% женщин с тяжелыми менструальными кровотечениями с анемией потребовалась трансфузия эритроцитарной массы, для сравнения у госпитализированных женщин с обильными менструальными кровотечениями без анемии этот показатель составил лишь 0,7%12.
Анемия часто встречается у женщин, госпитализированных по гинекологическим показаниям, сопровождающимся тяжелыми менструальными кровотечениями. По результатам исследования, проведенного Morrison и соавторами, почти 27% женщин с тяжелым менструальным кровотечением с анемией нуждались в экстренной госпитализации, для сравнения этот показатель среди женщин с тяжелым менструальным кровотечением без анемии составлял всего 3,2%. Средняя продолжительность пребывания женщин с тяжелыми менструальными кровотечениями в сочетании с анемией была на 25% дольше, чем у женщин без диагноза анемии: 3,0 дня и 2,4 дня соответственно12.

Женщины с тяжелыми менструальными кровотечениями с большей вероятностью используют ресурсы системы здравоохранения, чем здоровые женщины, что формирует измеримое экономическое бремя14.

Анемия у женщин с тяжелым менструальным кровотечением диагностируется при концентрации гемоглобина менее 120 г/л.

Варианты лечения тяжелых менструальных кровотечений включают медикаментозное лечение (например, гормональное и/или гемостатическое лечение) или хирургическое вмешательство. Из-за желания сохранить фертильность в будущем хирургическое лечение применяют только при жизнеугрожающих кровотечениях16. Любое вмешательство в случае обильного менструального кровотечения должно быть направлено на снижение его негативного влияния на качество жизни женщины15.






Анемия ассоциирована с неблагоприятными исходами любых оперативных вмешательств.
Это обусловлено двумя взаимосвязанными факторами:
- изменённый айрон-статус служит причиной неэффективного эритропоэза и нарушенной адаптации организма к стрессовым ситуациям29;
- сниженный уровень гемоглобина увеличивает вероятность периоперационных переливаний компонентов крови26.





Настороженность нужна не только в случае выраженной анемии. По результатам исследования Американской коллегии хирургов (American College of Surgeons, ACS), осложнённое течение послеоперационного периода характерно для пациентов с любым изменением уровня гемоглобина27.



Несмотря на то, что диагностическим критерием анемии служит уровень гемоглобина 120 г/л (ВОЗ), некоторые специалисты в периоперационной подготовке пациентов даже женского пола рекомендуют стремиться к более высокому показателю 130 г/л, аргументируя это лучшими исходами хирургических вмешательств42.

Мировая практика
В руководствах Европейского общества анестезиологов и Health Quality Ontario рекомендуется лечить анемию до операции с использованием пероральных или внутривенных препаратов железа, с целью достижения уровня гемоглобина более 120 г/л20.
В 2017 году Muñoz M. и соавт. разработали серию положений, основанных на передовой практике и доказательной медицине, чтобы предоставить рекомендации по оказанию помощи пациентам с анемией и дефицитом железа в периоперационном периоде. Эти положения включают в себя подход к диагностике анемии и дефицита железа у пациентов хирургического профиля, выявление пациентов, которым необходимо лечение, а также рекомендации по практическому лечению и последующему наблюдению30.



Это позволит клиницистам интерпретировать гематологические результаты с запасом времени, которое даст возможность исправить обратимый недостаток факторов кроветворения. В случаях экстренных операций, когда отложить операцию до полной коррекции анемии не представляется возможным, также целесообразно установить диагноз анемии и начать лечение32.
После выполнения оценки, следует как можно раньше начать лечение предоперационной анемии с применением препаратов железа22, 30, 31.


Если проведение операции запланировано менее чем через 6 недель рекомендуется вводить внутривенные препараты железа (а не пероральные)30.

Для восполнения айрон-статуса в арсенале акушера-гинеколога есть большой выбор пероральных препаратов — соединений двухвалентного (сульфат, хлорид, глюконат и фумарат) и трёхвалентного железа (гидроксид полимальтозный комплекс). Их свойства различны, что обусловлено химическим строением действующего вещества и наличием дополнительных компонентов, влияющих на фармакокинетику лекарственного средства.
Компенсировать дефицит микроэлемента при помощи назначения препаратов внутрь возможно спустя достаточно продолжительный период: нормализацию уровня гемоглобина (при условии уменьшения или исчезновения кровопотери) отмечают через 8–16 недель, восстановление депо железа — через 4–7 месяцев34-37.



Терапия пероральным препаратом железа может занять слишком много времени для эффективного восполнения запасов железа у пациентов, которым запланирована операция. Это связано с тем, что пероральные препараты железа характеризуются низкой биодоступностью (10-15%) и низкой абсорбцией, которая может быть еще более низкой из-за гепсидина при воспалительных состояниях. Кроме того, желудочно-кишечная непереносимость пероральных препаратов железа может послужить причиной низкого комплаенса со стороны пациенток. С другой стороны, внутривенные препараты железа более эффективно повышают уровень гемоглобина, в сравнении с пероральными препаратами железа (сульфатом железа), обеспечивая тем самым более быстрое восполнение запасов железа. Кроме того, внутривенные препараты железа не вызывают побочных эффектов со стороны желудочно-кишечного тракта или характеризуются хорошей приверженностью пациентов проводимой терапии33,41.
В 2014 году в РФ были опубликованы клинические рекомендации «Кровесберегающие технологии у гинекологических больных» под редакцией Г.Т. Сухих и соавт., в которых авторы уделают внимание, в том числе, вопросам диагностики и лечения ЖДА у женщин с ОМК.


В 2021 году в РФ опубликован Алгоритм ведения пациентов с анемией перед плановым хирургическим вмешательством на этапе ПМСП, который суммирует диагностическую и лечебную тактику в случае ведения пациентов с ЖДА перед операцией.


*Больший процент пациентов, которым назначен в/в ЖКМ , в сравнении с пациентами, которым назначен пероральный препарат железа, достиг увеличения Hb ≥2 г/дл в течение 42 дней после исходного этапа (82,0% против 61,8%; 95% ДИ для разницы между терапиями, 12,2%-28,3%; p < 0.001). ЖКМ — железа карбоксимальтозат; ЖС — железа сульфат; Hb — гемоглобин; ОМК — обильное менструальное кровотечение; СФ — сывороточный ферритин; TSAT — сатурация трансферрина.
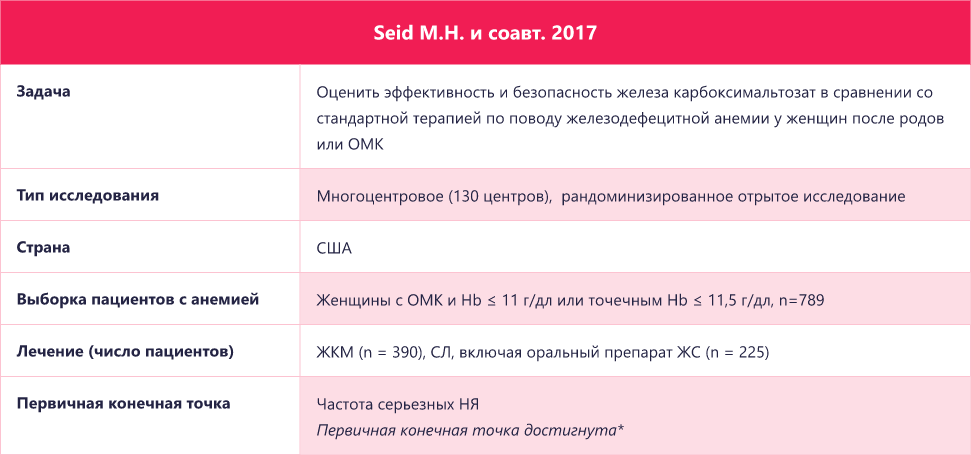
*Частота серьезных НЯ статистически значимо больше среди пациентов в группе СЛ (22/1022, 2.2%) чем среди пациентов в группе ЖКМ (6/996, 0.6%) (p=0.004). В данном анализе объединили женщин после родов и женщин с ОМК. ЖКМ — железа карбоксимальтозат; ЖС — железа сульфат; Hb — гемоглобин; ОМК — обильное менструальное кровотечение; СФ — сывороточный ферритин; СЛ — стандартное лечение.
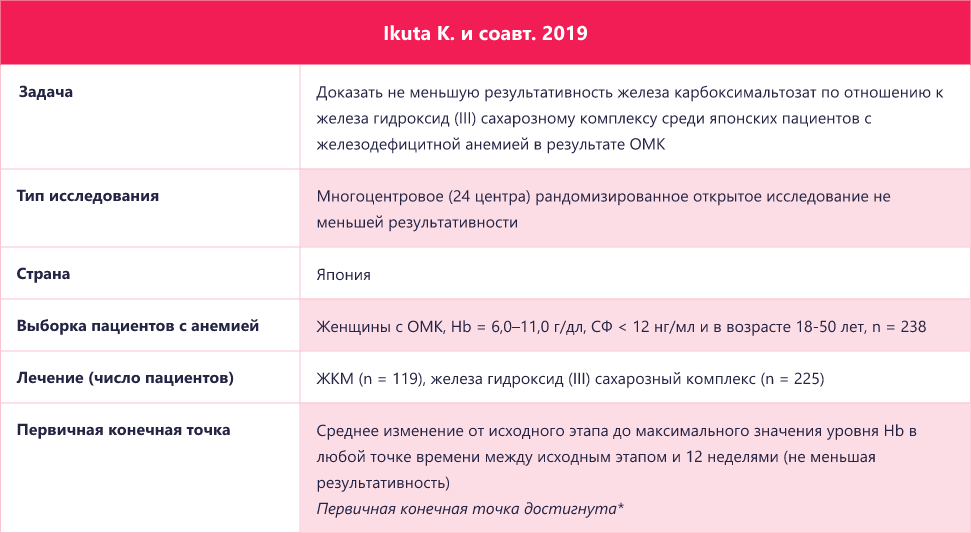
*Скорректированное среднее изменение уровня Hb от исходного этапа составило 3.90г/дл (3.77, 4.04) в группе ЖКМ и 4.05 г/дл (3.92, 4.19) в группе СОЖ (SFO, сахарат оксида железа); 95% ДИ для разницы между группами = −0.15 г/дл (− 0.35, 0.04). ЖКМ — железа карбоксимальтозат; Hb — гемоглобин ; ОМК — обильное менструальное кровотечение; ЖСах — железа сахароза; ДИ — доверительный интервал; СФ — сывороточный ферритин; TSAT — сатурация трансферрина.

*Доля пациентов, достигавших уровня Hb ≥10 г/дл в течение 2 недель была схожей в группе ЖКМ (78.8%) и в группе ЖСах (72.3%) (p=0.452). ЖКМ — железа карбоксимальтозат; Hb — гемоглобин; ОМК — обильное менструальное кровотечение; ЖСах — железа сахароза; TSAT — сатурация трансферрина.
- Ayers DM et al. Nursing. 2009;39(1):44-50
- Magnay JL et al. BMC Women’s Health. 2018;18:142
- Liu Z et al. Value Health. 2007;10(3):183-194
- Hapangama DK and Bulmer JN. Womens Health (Lond). 2016;12(1):3-13
- https://www.who.int/vmnis/anaemia/prevalence/summary/anaemia_data_status_t2/en/
- WHO. The global prevalence of anaemia in 2011. Geneva. 2015
- Fraser IS et al. Int J Gynecol Obstet. 2015;128:196-200
- Percy L et al. Best Pract Res Clin Obstet Gynaecol. 2017;40:55-67
- Breymann C et al. Geburtshilfe Frauenheilkd. 2013;73:256-261
- Mayo Clinic. 2018. Available at: https://www.mayoclinic.org/diseases-conditions/menorrhagia/symptoms-causes/syc-20352829. Accessed November 2021
- Peuranpää et al. Acta Obstet Gynecol Scand. 2014;93:654–660
- Morrison J et al. J Reprod Med. 2008;53(5):323-330
- Jensen et al. J Women's Health (Larchmt). 2012;21(5):539–547
- Nelson AL and Ritchie JJ. Am J Obstet Gynecol. 2015;213(1):97.e1-e6
- NICE Guideline. Heavy menstrual bleeding: assessment and management. 2018
- Marret H et al. Eur J Obstet Gynecol Reprod Biol. 2010;152:133-137
- Royal College of Physicians of Ireland and Health Service Executive. 2015
- Australian Commission on Safety and Quality in Health Care. 2017
- Singh S et al. J Obstet Gynaecol Can. 2013;35(5):S1-S29
- Health Quality Ontario. 2017
- WHO. Haemoglobin concentrations for the diagnosis of anaemia and assessment of severity. Vitamin and Mineral Nutrition Information System. Geneva: World Health Organization; 2011 (WHO/NMH/NHD/MNM/11.1) Available at: https://www.who.int/vmnis/indicators/haemoglobin.pdf Accessed November 2021
- Kozek-Langenecker SA et al. Eur J Anaesthesiol. 2017;34:332-395
- Leichtle SW et al. J Blood Dis Transf 2011;S1:002.
- Creteur et al. Crit Care. 2009;13 Suppl 5:S11.
- Marik PE et al. JAMA 1993;269(23):3024-9.
- Fowler AJ et al. Br J Surg. 2015;102(11):1314-1324
- Musallam KM et al. Lancet. 2011;378(9800):1396–1407
- Beattie WS et al. Anesthesiology. 2009;110(3):574-581
- Crichton RB et al. Iron therapy - With Special Emphasis on Intravenous Administration. 4th Ed. UNI-MED Verlag AG. Bremen. 2008
- Muñoz M et al. Anaesthesia. 2017;72:233-247
- Beris P et al. Br J Anaesth. 2008;100(5):599–604
- Froessler B et al. Ann Surg. 2016;264(1):41–46
- Clevenger B and Richards T. Anaesthesia. 2015;70(Suppl 1):20-28
- Fehr J et al. Praxis 2009;98:1445–51;
- Gordeuk VR et al. Am J Clin Nutr 1987;46:1029–34;
- Aapro M et al. Ann Oncol 2012;23:1954–62;
- Auerbach M et al. Hematology Am Soc Hematol Educ Program 2010;2010:338–47
- Geisser P, Burckhardt S. Pharmaceutics 2011;3:12–33;
- Christoph P et al. J Perinat Med 2012;469–74; 3. Ferinject SmPC 2017
- Ferinject SmPC 2020
- Baird-Gunning J and Bromley J. Aust Prescr. 2016;39:193–199
- Muñoz, M., et al. "‘Fit to fly’: overcoming barriers to preoperative haemoglobin optimization in surgical patients." British Journal of Anaesthesia 115.1 (2015): 15-24.
