



Структура железо-углеводного комплекса в препарате Феринжект® близка ферритину 37

Феринжект® абсорбируется макрофагами ретикуло- эндотелиальной системы38

Не происходит перегрузки системы трансферрина





ЗА ПЕРВЫЕ 8 ЧАСОВ ПОСЛЕ ВВЕДЕНИЯ ПРЕПАРАТА ФЕРИНЖЕКТ® В 16 РАЗ БОЛЬШЕ ЖЕЛЕЗА РАСПРЕДЕЛЯЕТСЯ В КОСТНЫЙ МОЗГ ПО СРАВНЕНИЮ С ОСТАЛЬНЫМИ ОРГАНАМИ-МИШЕНЯМИ (ПЕЧЕНЬЮ И СЕЛЕЗЕНКОЙ) 4.
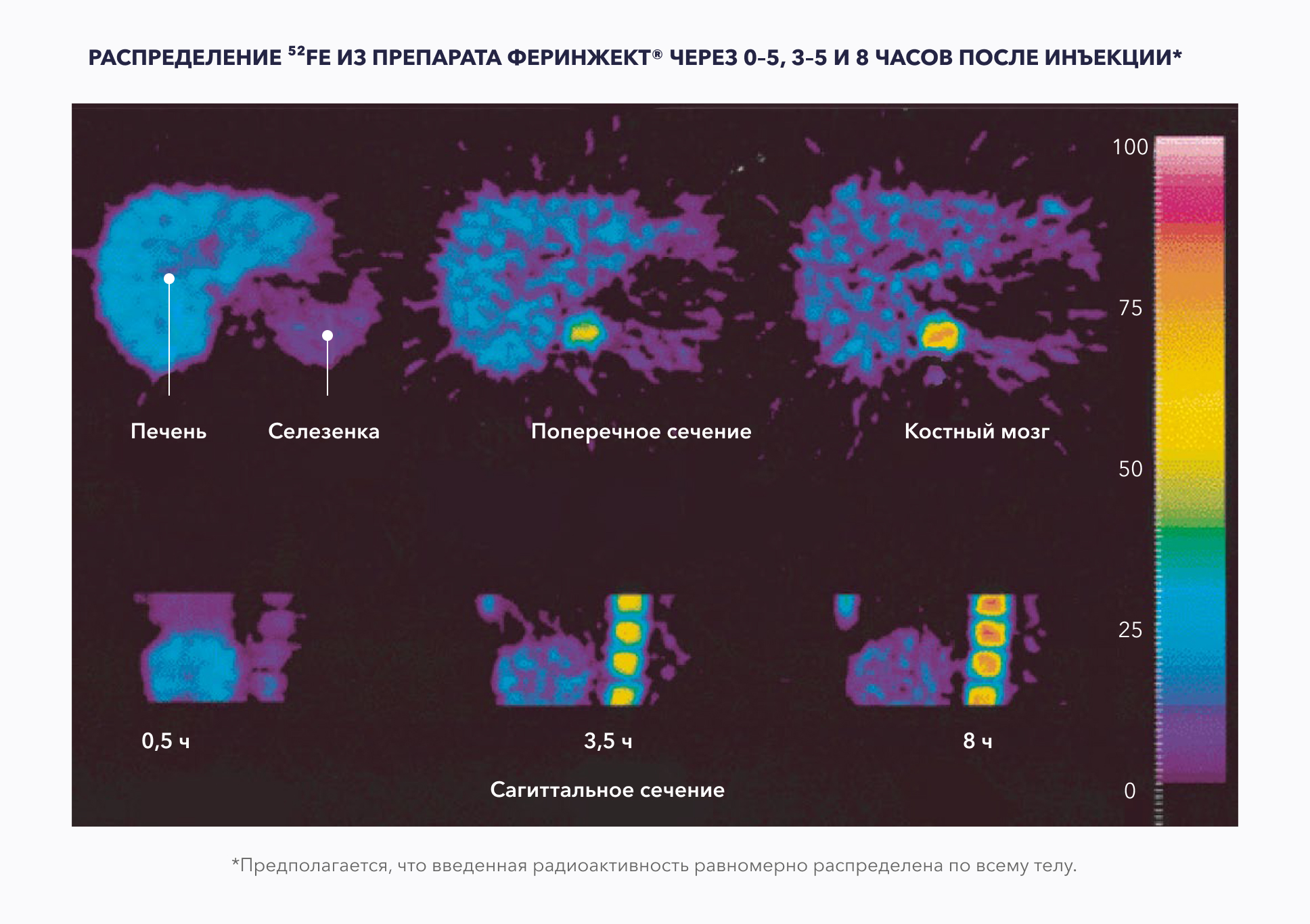


ЖЕЛЕЗО ИЗ ПРЕПАРАТА ФЕРИНЖЕКТ® УТИЛИЗИРУЕТСЯ В ТЕЧЕНИЕ 6–24 ДНЕЙ, ЧТО СПОСОБСТВУЕТ ДОСТИЖЕНИЮ БЫСТРОГО ГЕМАТОЛОГИЧЕСКОГО ОТВЕТА 1,4.

ПРИ ПРИМЕНЕНИИ ПРЕПАРАТА ФЕРИНЖЕКТ® ДО 90% ВВЕДЕННОГО ЖЕЛЕЗА МОЖЕТ ПОСТУПАТЬ В СОЗРЕВАЮЩИЕ ЭРИТРОЦИТЫ В ТЕЧЕНИЕ 6–9 ДНЕЙ *4.
* У пациентов с дефицитом железа и железодефицитной анемией


Это может приводить к более быстрому гемaтологическому ответу 1,4.








ВЫСОКАЯ СТАБИЛЬНОСТЬ КОМПЛЕКСА ЖЕЛЕЗА В ПРЕПАРАТЕ ФЕРИНЖЕКТ® 2 ОБЕСПЕЧИВАЕТ НИЗКОЕ СОДЕРЖАНИЕ СВОБОДНОГО ЖЕЛЕЗА В ПЛАЗМЕ3,37.

- Реакции гиперчувствительности при применении препарата Феринжект® встречаются нечасто 1
- В исследованиях in vitro не выявлено взаимодействия с антидекстрановыми антителами 1-3



В исследованиях препарта Феринжект® принимали участие беременные женщины.



ВРАЧИ ИМЕЮТ ШИРОКИЙ ОПЫТ ПРИМЕНЕНИЯ ПРЕПАРАТА ФЕРИНЖЕКТ®.





Каждого пациента следует наблюдать на предмет развития признаков или симптомов реакций гиперчувствительности в течение как минимум 30 минут после каждого введения раствора железа карбоксимальтозата

Детский возраст до 1 года является противопоказанием к применению препарата

Дефицит железа должен быть подтвержден лабораторными анализами

После восполнения уровня железа следует проводить регулярные оценки, чтобы убедиться в том, что уровень железа нормализовался и сохраняется на должном уровне

Оценку уровня Hb необходимо проводить не ранее чем через 4 недели после последнего применения препарата Феринжект®, чтобы дать достаточное время для эритропоэза и усвоения железа

Если пациенту необходимо дальнейшее восполнение запасов, то потребность в железе необходимо рассчитать повторно

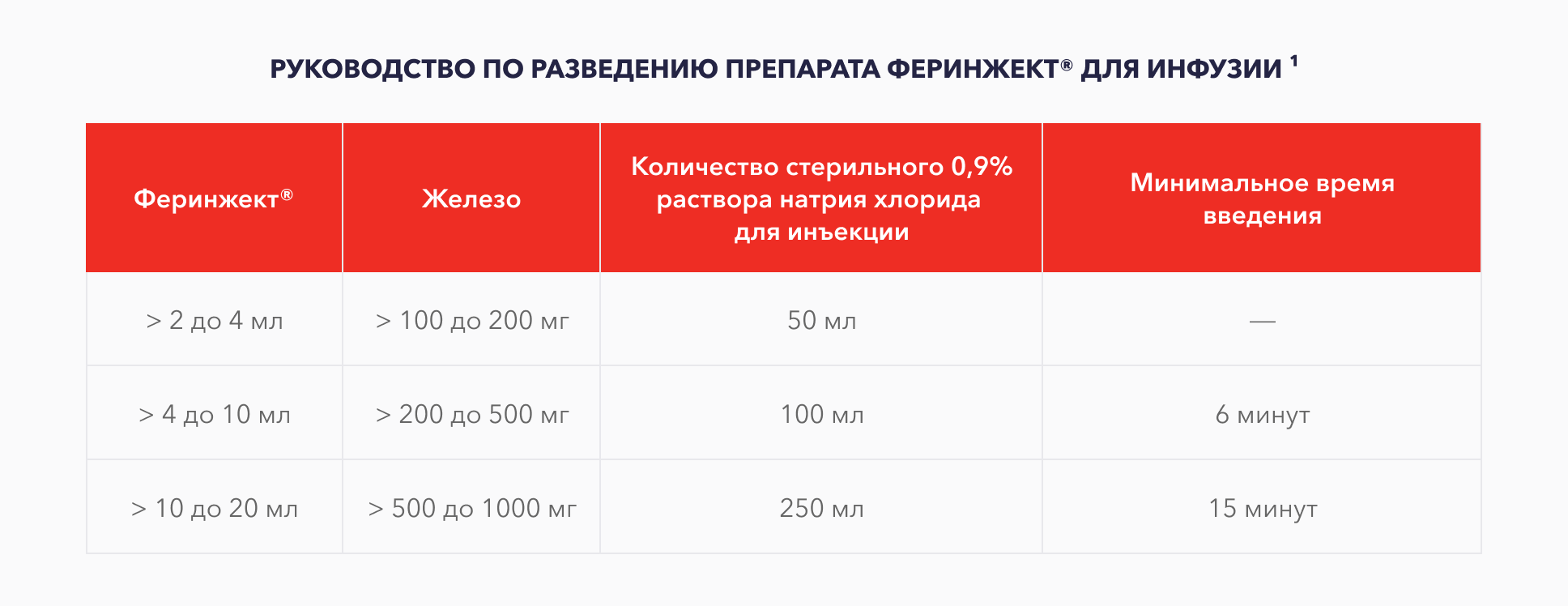
При разовом введении препарата Феринжект® в виде внутривенной инфузии доза не должна превышать 20 мг железа/кг массы тела

Максимальная рекомендуемая суммарная доза препарата Феринжект® в неделю составляет 1000 мг железа (20 мл препарата Феринжект®)
- Инструкция по медицинскому применению лекарственного препарата Феринжект®, раствор для в/в введения 50 мг/мл,регистрационное удостоверение: ЛРС-008848/10.
- Funk F., et al. Arzneim. Forsch. 2010; 60 (6a): 345–53.
- Neiser S., et al. Int. J. Mol. Sci. 2016; 17: 1185.
- Beshara S., et al. Br. J. Haematol. 2003.
- Toblli J.E., et al. Nephrol. Dial. Transplant. 2010; 25: 3631–40.
- Toblli J.E. et al. Drug Res (Stuttg) 2015; 65: 354–60.
- Anker SD et al. NEJM. 2009;361:2436–2448.
- Ponikowski P et al. Eur Heart J. 2015;36:657–668.
- Van Veldhuisen DJ et al. Circulation. 2017;136:1374–1383.
- Ponikowski P et al. The Lancet. 2020;396(10266):1895–1904.
- Kulnigg S et al. Am J Gastroenterol. 2008;103:1182–1192.
- Evstatiev R et al. Clinical Gastro Hepatol. 2013;11:269–277.
- Evstatiev R et al. Gastroenterol. 2011;141(3):846–853.
- Kulnigg-Dabsch S et al. Inflamm Bowel Dis. 2013;19:1609–1616.
- Qunibi WY et al. Nephrol Dial Transplant. 2011;26:1599–1607.
- Charytan C et al. Nephrol Dial Transplant. 2013;28:953–964.
- Onken JE et al. Nephrol Dial Transplant. 2014;29:833-842.
- Macdougall IC et al. Nephrol Dial Transplant 2014;29(11):2075–2084.
- Ikuta K. et al. Int J Hematol. 2019;109(1):41–49.
- Van Wyck DB et al. Obstet Gynecol. 2007;110:267–278.
- Breymann C et al. J Perinat Med. 2017;45:443–453.
- Seid MH et al. Am J Obstet Gynecol. 2008;199(4):435.e1–7.
- Van Wyck DB et al. Transfusion. 2009;49:2719–2728.
- Favrat B et al. PLoS ONE. 2014;9(4):e94217.
- Breymann C et al. Int J Gynaecol Obstet 2008; 101: 67–73.
- Seid MH et al. Anemia. 2017;Article ID:9642027.
- Allen RP et al. Sleep Med. 2011;12(9):906–913.
- Trenkwalder C et al. Mov Disord. 2017;32(10):1478–1482.
- Hedenus M et al. Med Oncol. 2014;31(12):302.
- Bailie GR et al. Hemodialysis Int. 2010;14:47–54.
- Geisser P and Banké-Bochita J. Arzneim Forsch. 2010;60(6a):362–372.
- Barish CF et al. Anemia. 2012;Article ID:172104.
- Hussain I et al. Anemia. 2013;Article ID:169107.
- Onken JE et al. Transfusion. 2014;54:306–315.
- Boomershine CS et al. Rheumatol Ther. 2018;5:271–281.
- CSL Vifor Global Press Release 2023.
- Van Wyck DB et al. Transfusion. 2009;49:2719–2728.
- Jahn MR, et al. Eur J Pharm Biopharm. 2011;78:480-491.





