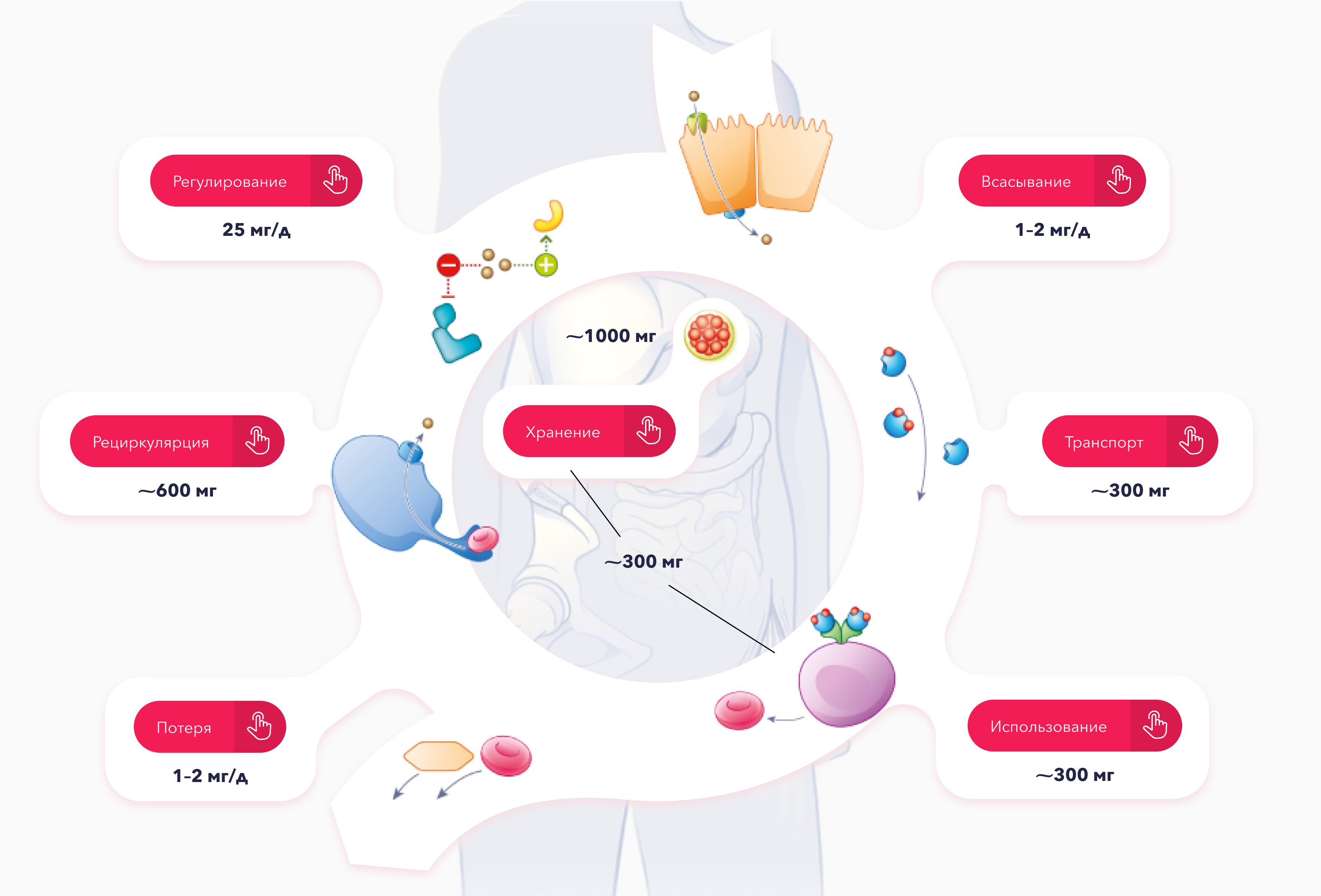
Не существует контролируемых механизмов выведения избытка железа, поэтому гомеостаз железа в организме регулируется на участках всасывания, использования и и рециркуляции.
Поддержание оптимального уровня железа в кровотоке имеет решающее значение для функционирования клеток и тканей.
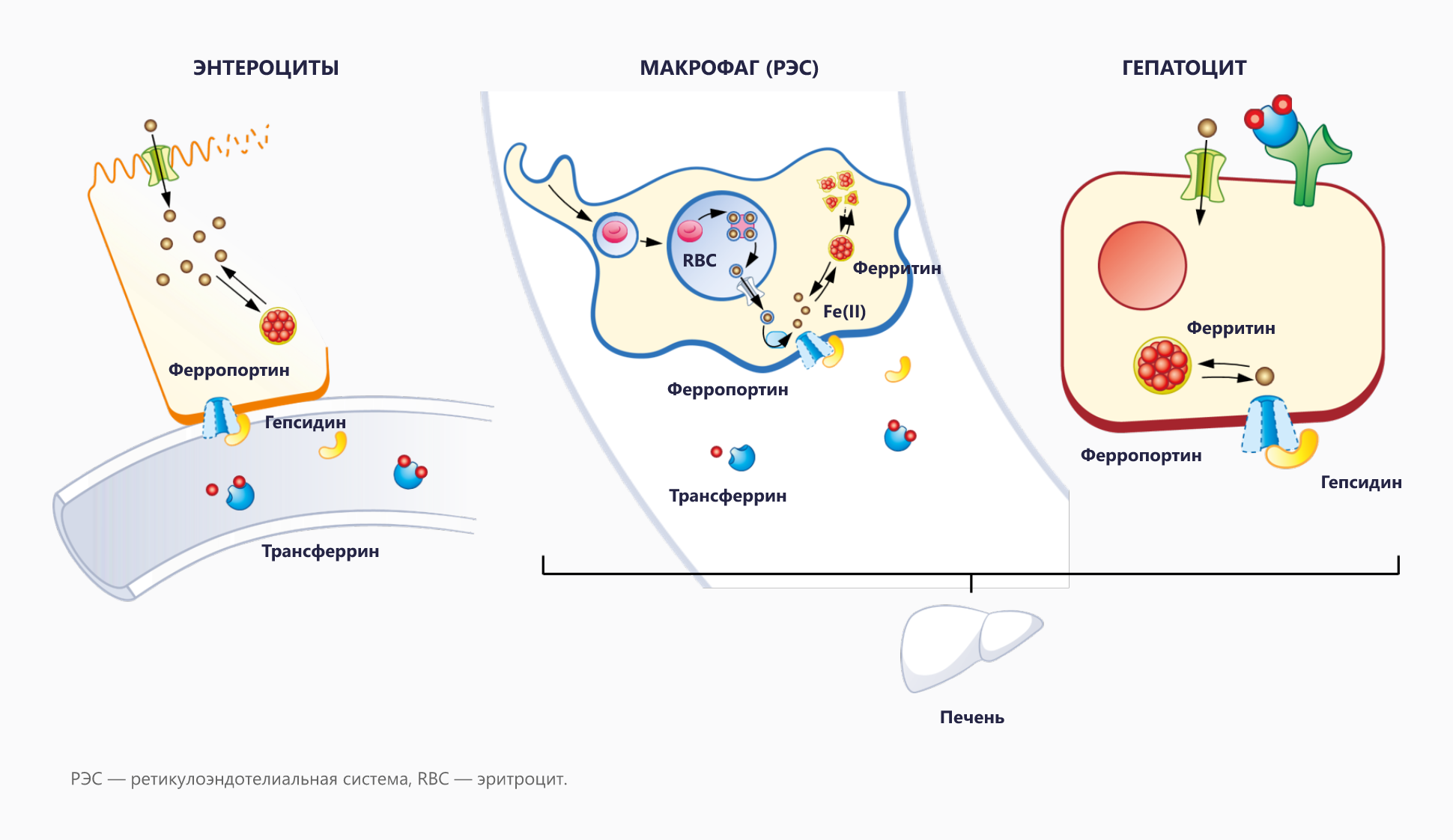
Механизмы, которые регулируют поступление железа в плазму (системный гемостаз), в основном сосредоточены на печени и включают две молекулы, гепсидин и ферропортин, которые работают вместе для регулирования поступления железа из клеток в системный кровоток.
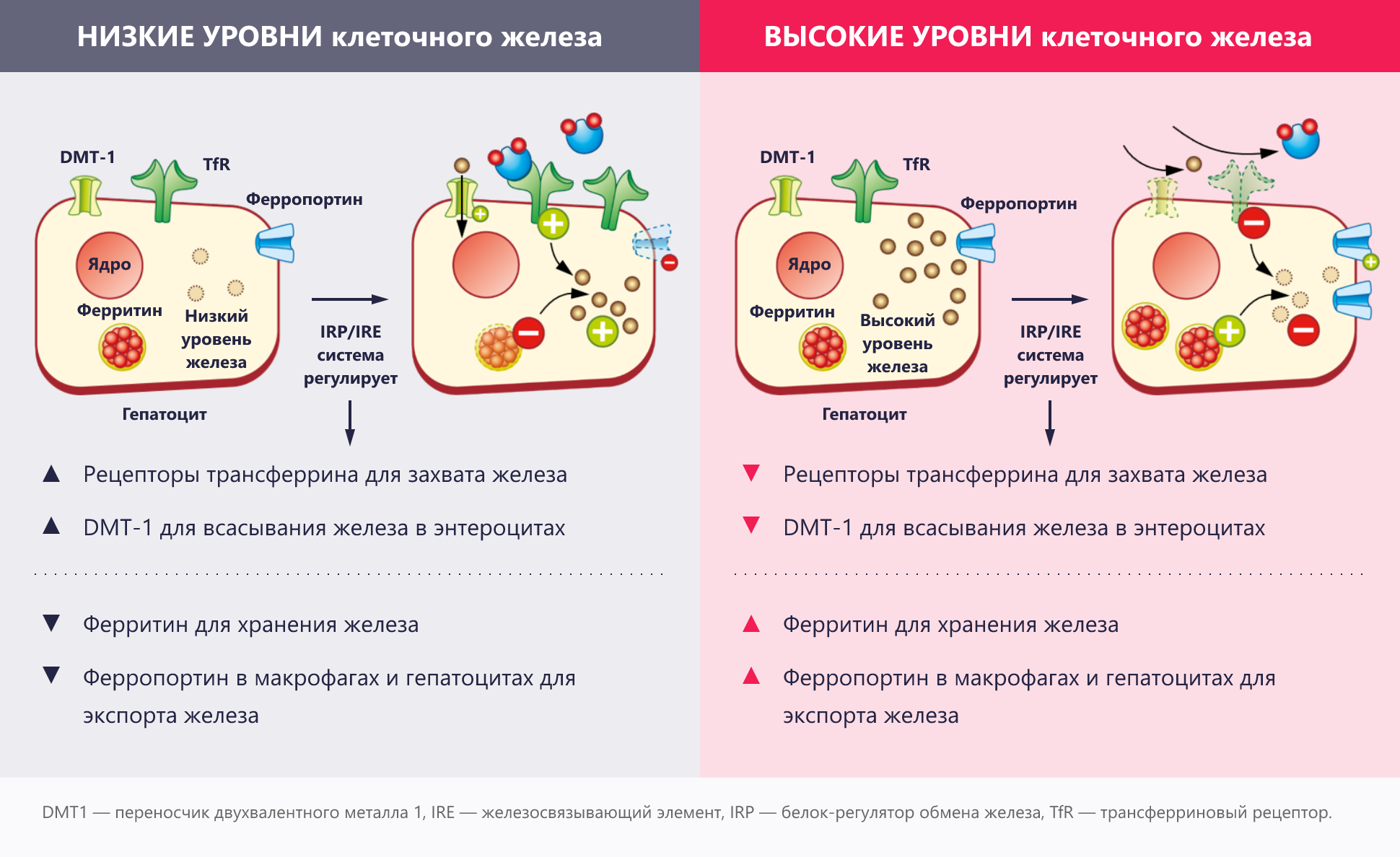
Клеточный баланс железа включает взаимодействие железорегуляторных белков (IRP) с железорегуляторными элементами (IRE)23.
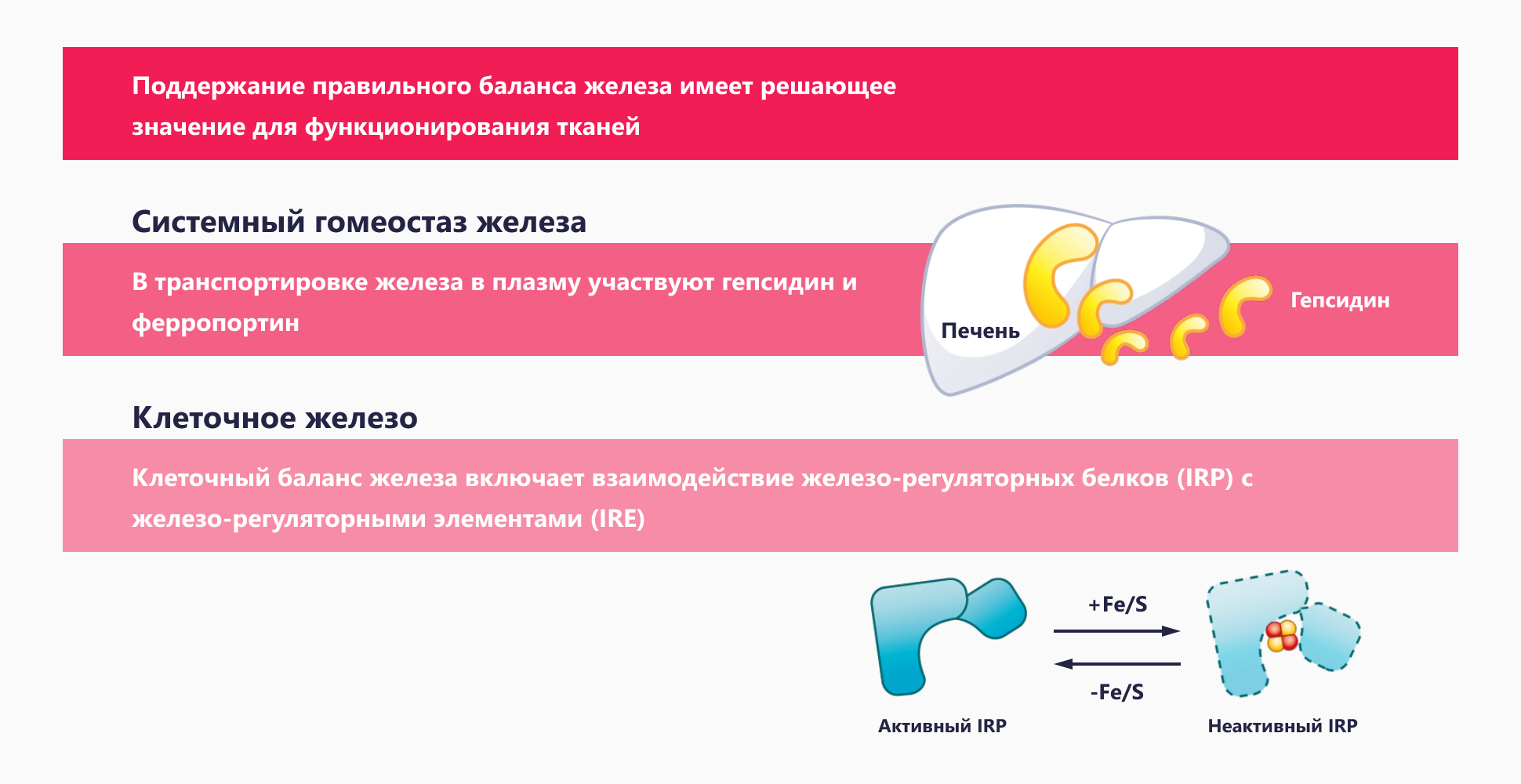

Гепсидин регулирует системный гомеостаз железа.
Пептидный гормон гепсидин в основном вырабатывается в гепатоцитах и регулирует концентрацию железа в плазме. Молекулярной мишенью гепсидина является клеточный экспортер железа ферропортин. Ферропортин поставляет железо в плазму из энтероцитов двенадцатиперстной кишки, участвующих в всасывании железа из пищи, макрофагов селезенки и печени, которые перерабатывают старые эритроциты, и гепатоцитов, участвующих в хранении железа. Гепсидин является лигандом ферропортина. Их взаимодействие приводит к быстрому убиквитинированию ферропортина, эндоцитозу и деградации комплекса лиганд-рецептор. Выключение ферропортина клеточных мембран уменьшает доставку железа в плазму. Если гепсидин хронически повышен, постоянная гипоферремия может привести к развитию дефицита железа и железодефицитной анемии. И наоборот, хронический дефицит гепсидина приводит к чрезмерному всасыванию железа, повышению уровня железа, не связанного с трансферрином, в кровотоке и развитию перегрузки железом.

IRP и IRE контролируют баланс клеточного железа7.
Регуляторные белки железа (IRP) представляют собой растворимые цитозольные белки, которые изменяют свою активность в соответствии с уровнем.
- Barragan-Ibanez G. et al. Rev Med Hosp Gen Mex. 2016; 79: 88-97.
- Aisen, 1992.
- Национальные клинические рекомендации перегрузка железом: диагностика и лечение. 2018; https://npngo.ru/uploads/media_document/289/d4dc2f81-4968-4ab0-883a-0d26027f8e46.pdf
- Kruszewski M. Mutat. Res. 2003; 531(1-2): 81-92.
- Dev S. and Babitt J.L. Hemodialysis International. 2017; 21:S6–S20.
- Silva B. and Faustino P. Biochimica et Biophysica Acta. 2015; 1852: 1347–1359.
- Hentze M.W. et al. Cell. 2010; 142: 24-38.
- Zhang C. Protein Cell. 2014; 5:750–760.
- Muckenthaler M.U. et al. Cell. 2017; 168: 344-361.
- Lasserre J.P. et al. Dis Model Mech. 2015; 8: 509-26.
- Musallam K.M. and Taher A.T. Curr Med Res Opin. 2018; 34: 81-93.
- Manikandan P. and Nagini S. Curr Drug Targets. 2018; 19: 38-54.
- Radlowski E.C. and Johnson R.W. Front Hum Neurosci. 2013; 7: 585.
- Balucan F.S. et al. J Thyroid Res. 2013; 2013: 182472.
- Besarab A. et al. Oncologist. 2009; 14(Suppl 1): 22–33.
- Jankowska E.A. et al. Eur Heart J. 2013; 34: 816–826.
- Pittman R.N. Regulation of Tissue Oxygenation. 2011. San Rafael (CA): Morgan & Claypool Life Sciences.
- Kalantar-Zadeh K. et al. Adv Chronic Kidney Dis. 2009; 16(2): 143-15.
- MRC Mitochondrial Biology Unit. http://www.mrc-mbu.cam.ac.uk/what-are-mitochondria.
- Cooper G.M. The Cell: A Molecular Approach. 2nd ed. Sunderland (MA): Sinauer Associates; 2000.
- Stugiewicz M. et al. European Journal of Heart Failure. 2016; 18: 762–773.
- Knutson M. and Wessling-Resnick M. Critical Reviews in Biochemistry and Molecular Biology. 2003; 38: 61–88.
- Wallace D.F. Clin Biochem Rev. 2016; 37: 51-62.